
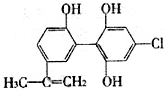
 在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )
在2010年温哥华冬奥会上,有个别运动员因服用兴奋剂被取消参赛资格.如图是某兴奋剂X的结构简式,下列有关说法正确的是( )| A. | 1molX在一定条件下与足量的氢气反应,最多消耗1molH2 | |
| B. | 1molX与足量的Na反应,最多产生标况下33.6LH2 | |
| C. | 1molX与足量的浓溴水反应,最多消耗5molBr2 | |
| D. | 1molX与足量的NaOH溶液在一定条件下反应,最多消耗5molNaOH |
分析 A.能和氢气发生加成反应的是苯环和碳碳双键;
B.醇酚羟基都能与钠反应生成氢气;
C.苯环上酚羟基的邻对位氢原子、碳碳双键都能和溴发生反应;
D.能和氢氧化钠溶液反应的是酚羟基.
解答 解:A.碳碳双键和苯环都能和氢气发生加成反应,所以1mol X在一定条件下与足量的氢气反应,最多消耗7mol H2,故A错误;
B.2个-OH,与足量的Na反应,生成1个氢气,1molX与足量的Na反应,最多产生1.5molH2,标况下体积为33.6L,故B正确;
C.苯环上酚羟基的邻对位氢原子可以被取代、碳碳双键能和溴发生加成反应,所以1molX 与足量的浓溴水反应,最多消耗4mol Br2,故C错误;
D.能和氢氧化钠溶液反应的是酚羟基、氯原子,所以最多消耗5mol NaOH,故D错误;
故选B.
点评 本题考查有机物的官能团和性质,明确物质的结构是解答本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
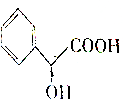 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
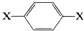 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )| A. | 该有机物燃烧时一定只生成CO2和H2O | |
| B. | 该有机物不可能为芳香醇 | |
| C. | 该有机物的分子式可能为C8H10O2 | |
| D. | 该有机物可能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 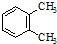 与 与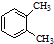 是同分异构体 是同分异构体 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com