
| A. | ①② | B. | ②③④ | C. | ②③ | D. | ①③④ |
分析 ①中和反应实质是氢离子与氢氧根离子反应生成水;
②碳酸氢钠能够与盐酸反应生成二氧化碳和水、氯化钠;
③氢氧化钙为碱,能够与酸发生酸碱中和反应;
④氨水与蚁酸反应生成铵盐和水;
解答 解:①用氢氧化钠溶液洗涤石油产品中的残余硫酸,反应生成硫酸钠和水,属于中和反应,故选;
②碳酸氢钠能够与盐酸反应生成二氧化碳和水、氯化钠,不是中和反应,故不选;
③氢氧化钙为碱,能够与酸发生酸碱中和反应生成盐和水,降低土壤酸碱度,属于中和反应,故选;
④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒,属于中和反应,故选;
故选:D.
点评 本题考查了中和反应的判断,明确中和反应是酸和碱反应生成盐和水的概念是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸变蓝色的溶液中:K+、Al3+、NO3-、SO42- | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 有较多Fe3+的溶液中:Na+、SCN-、K+、Na+、CO32- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | 胆矾、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 | |
| D. | SiO2、NO2、Al2O3都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等但密度不等的N2和C2H4 | B. | 体积相同的N2和C2H4 | ||
| C. | 等温、等体积的N2和O2 | D. | 等压、等体积N2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K层 | B. | L层 | C. | M层 | D. | N层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
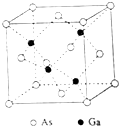 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com