
有V mL浓度为c mol·L-1的硫酸铝溶液中,![]() 的浓度为________mol·L-1,
的浓度为________mol·L-1,![]() 的物质的量为________mol,加水稀释至2V mL后,Al3+的浓度为________mol·L-1,Al3+离子的物质的量为________mol.
的物质的量为________mol,加水稀释至2V mL后,Al3+的浓度为________mol·L-1,Al3+离子的物质的量为________mol.
科目:高中化学 来源: 题型:阅读理解

| 36cV×10-3 |
| a |
| 36cV×10-3 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
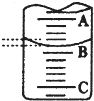 某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00 mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.
某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00 mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| (23.35+25.30)c |
| 2V |
| (23.35+25.30)c |
| 2V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
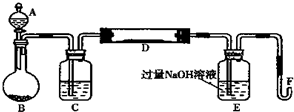
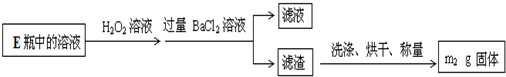
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com