
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
分析 A.不能确定是否含有Fe2+;
B.无水硫酸铜遇水变蓝色;
C.不能确定是否含有K+;
D.I-为无色离子.
解答 解:A.Fe3+与KSCN反应,溶液变红色,不能确定是否含有Fe2+,如检验Fe2+,可用溴水或高锰酸钾,故A错误;
B.无水硫酸铜遇水变蓝色,可证明含有水,故B正确;
C.不能确定是否含有K+,检验钾离子,可透过蓝色钴玻璃,以滤去黄光,故C错误;
D.I-为无色离子,碘的四氯化碳溶液呈紫色,故D错误.
故选B.
点评 本题考查了常见离子的检验方法,题目难度不大,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,该类试题需要注意的是进行离子检验时,要依据离子的特殊性质和特征反应进行判断.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
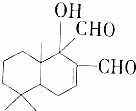
| A. | 既能发生氧化反应,又能发生酯化反应 | |
| B. | 与FeC13溶液发生反应后,溶液显紫色 | |
| C. | 1mol该有机物最多可与2molCu(0H)2反应 | |
| D. | 1mol该有机物最多可与1molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g)?2SO3 (g)],不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等做法能保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
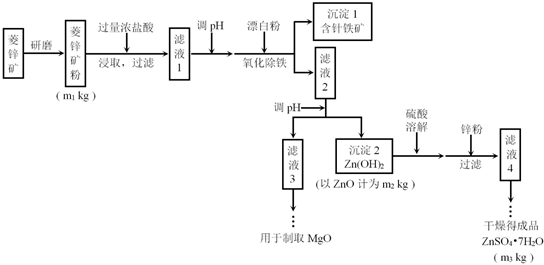
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
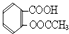 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

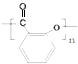 .
.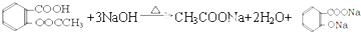 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由Na+与O22-(填写离子符号)构成的.
,它是由Na+与O22-(填写离子符号)构成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)=n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com