
 .
.分析 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.
根据原子的核外电子层数:B=C=2A,可知A为H元素,B、C为第二周期元素,原子的最外层电子数A=D,则D为Na元素,
B原子的基态原子电子排布,所有能级均处于全充满或半充满状态,可知B为N元素,
根据原子的最外层电子数:A+B=C,可知C为O元素,
原子的最外层电子数:C=E,可知E为S元素,
F的+3价阳离子基态价电子排布为3d5,则原子核外电子排布式为1s22s22p63s23p63d64s2,为26号元素,为Fe元素;
结合元素化合物的性质与元素周期律分析解答.
解答 解:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.
根据原子的核外电子层数:B=C=2A,可知A为H元素,B、C为第二周期元素,原子的最外层电子数A=D,则D为Na元素,
B原子的基态原子电子排布,所有能级均处于全充满或半充满状态,可知B为N元素,
根据原子的最外层电子数:A+B=C,可知C为O元素,
原子的最外层电子数:C=E,可知E为S元素,
F的+3价阳离子基态价电子排布为3d5,则原子核外电子排布式为1s22s22p63s23p63d64s2,为26号元素,为Fe元素;
(1)B为N元素,N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道表示式为 ,故答案为:
,故答案为: ;
;
(2)甲是H、O两元素按原子个数比2:1组成常见化合物H2O,H2O中O原子的价层电子对数为2+$\frac{1}{2}$(6-2×1)=4,所以H2O的VSEPR模型为四面体,由于含有2个孤电子对,所以分子的立体构型为V形;
故答案为:四面体;V形;
(3)上述元素中,H、N、O、S、Fe五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,则含有硫酸根离子,加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝色的气体,则含有铵根离子,所以该复盐的化学式NH4Fe(SO4)2;为检验复盐中某有色离子的存在,即检验Fe3+,遇到KSCN溶液会变红色,其反应的离子方程式为:Fe3++SCN-=Fe(SCN)3;
故答案为:NH4Fe(SO4)2;Fe3++SCN-=Fe(SCN)3;
(4)Fe3+在碱性条件下可被NaClO氧化为+6价的含氧酸根离子即FeO42-,ClO-被还原为Cl-,该反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
点评 本题考查结构性质位置关系应用,试题综合考查学生分析问题的能力,正确推断各元素为解答关键,注意掌握电子式的书写、价层电子对互斥理论的应用以及相关物质的性质,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
 可简化为
可简化为 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为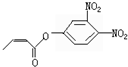 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A. | 均能发生银镜反应 | B. | 遇FeCl3溶液均显紫色 | ||
| C. | 均能与NaHCO3溶液发生反应 | D. | 均能与浓溴水发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IVA族 | B. | 第三周期 IV A族 | C. | 第三周期 VI A族 | D. | 第二周期VI A族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 甲烷和丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<硝基苯 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
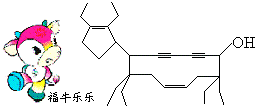
| A. | 牛式二烯炔醇含有4种官能团 | |
| B. | 牛式二烯炔醇不能使酸性KMnO4溶液褪色 | |
| C. | 1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应 | |
| D. | 该有机物的化学式为C29H44O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
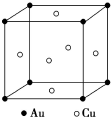 金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).
金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com