
| ||
| ||
| 0.56L |
| 22.4L/mol |
| 0.04mol |
| 0.1L |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
 按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量.下列叙述不正确的是( )
按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量.下列叙述不正确的是( )| A、F表示反应生成Cu的物质的量 |
| B、E表示反应消耗H2O的物质的量 |
| C、E表示反应生成O2的物质的量 |
| D、F表示反应生成H2SO4的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
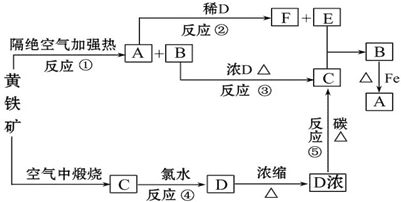
| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84% |
| SO3 | -- | 7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.01×1023 个 |
| B、0.5mol |
| C、1.505×1024 个 |
| D、1.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com