
下列说法正确的是
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H>0
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
环保、安全的铝--空气电池的工作原理如图所示,下列有关叙述错误的是
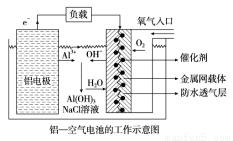
A.NaCl的作用是增强溶液的导电性
B.正极的电极反应式为O2+4e-+2H2O==4OH-
C.电池工作过程中,电解质溶液的pH不断增大
D.用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.配制一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1~2 cm时,改用胶头滴管定容
B.向某溶液中先加入Ba(NO3)2溶液,再加入足量的HNO3溶液,产生白色沉淀,则该溶液 中一定含有SO42-
中一定含有SO42-
C.分液操作时,将下层液体先放出,然后关闭旋塞,将上 层液体从
层液体从 上口倒出。
上口倒出。
D.石油的裂化可以提高汽油等轻质油的质量和产量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
反应A2+B2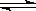 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的Cl-扩散到孔口,并与各电极产物作用生成多孔粉状锈Cu2(OH)3Cl。下列说法不正确的
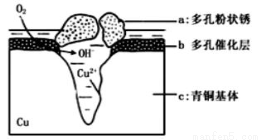
A.腐蚀过程中,负极c被氧化
B.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C.若生成2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为0.448L
D.正极的电极反应式为:正极反应是O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
现有A、B、C、D、E五种溶液分别是盐酸、醋酸、氢氧化钠溶液、氨水、碳酸钠溶液中的一种。常温下进行下列实验:
序号 | 实验步骤和结论 |
① | 比较浓度均为0.1 mol·L-1的A和E的pH的大小为:7<A<E |
② | 1 L pH=9的A分别与xL 0.001mol·L-1 B,yL 0.001mol·L-1 D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性。 |
(1)A的溶质是___________, D的溶质是___________,E的溶质是___________(均填化学式)
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为 _______________。
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈___________(填“酸”、“碱”或“中”)性。
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
有四种物质的量浓度相同且由一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH<7,BX的溶液的pH>7。则可能不水解的盐是
A.AX B.BX C.AY D.BY
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
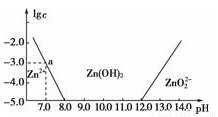
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
10mL浓度为1mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.KNO3 B.CH3COONa C.CuSO4 D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com