
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:分析 (1)由图可知,仪器的名称;NaBr与浓硫酸反应生成HBr,HBr与乙醇发生取代反应生成溴乙烷;利用量筒量取浓硫酸;
(2)加热时烧瓶中制备溴乙烷;
(3)冰水混合物可冷却生成物,溴乙烷的密度比水大;
(4)结合反应可知生成物;
(5)试管A中获得的有机物呈棕黄色,含溴单质,溴乙烷、溴均与碱反应,但溴乙烷与亚硫酸钠不反应,反应后分液可分离;乙烯能被高锰酸钾氧化;
(6)仪器连接部分都改成标准玻璃接口,可防止溴腐蚀橡胶.
解答 解:(1)由图可知,盛放反应物的仪器名称是圆底烧瓶;其中加入的反应物是溴化钠、乙醇和1:1的硫酸;利用量筒量取浓硫酸,
故答案为:圆底烧瓶;乙醇;b;
(2)加热时烧瓶中发生的主要反应的化学方程式为NaBr+H2SO4═HBr+NaHSO4、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O,
故答案为:NaBr+H2SO4═HBr+NaHSO4、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O;
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是冷却、液封溴乙烷,溴乙烷的密度比水大,则产物在第3层,
故答案为:冷却、液封溴乙烷;3;
(4)由NaBr+H2SO4═HBr+NaHSO4、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O可知,试管A中除了产物和水之外,还可能存在HBr、CH3CH2OH,
故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,含溴单质,溴乙烷、溴均与碱反应,但溴乙烷与亚硫酸钠不反应,则选择除杂试剂为d;乙醇在浓硫酸作用下可发生消去反应生成乙烯,能被高锰酸钾氧化,可知试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是乙烯,
故答案为:d;乙烯;
(6)建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是反应会产生Br2,腐蚀橡胶,故答案为:反应会产生Br2,腐蚀橡胶.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、实验装置的作用、习题中的信息为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加少量烧碱固体 | B. | 降低温度 | C. | 加少量冰醋酸 | D. | 加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
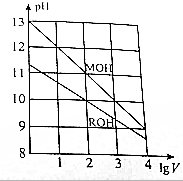 常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )
常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )| A. | MOH是强碱,ROH是弱碱 | |
| B. | 原ROH溶液的浓度为1.0mol/L | |
| C. | 常温下,ROH的电离平衡常数Kb约为1.1×10-5 | |
| D. | 当1gV=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}<10$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NaBr、KI三种无色溶液 | |
| B. | HCl、NaCl、NaNO3、Na2CO3四种溶液 | |
| C. | NaBr、KCl、HCl三种溶液 | |
| D. | 淀粉、淀粉碘化钾、KI、溴水四种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
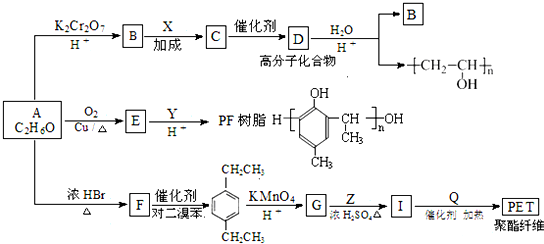
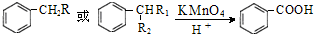 (R为H原子或烃基)
(R为H原子或烃基)
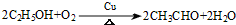
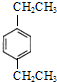 的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为
的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为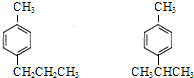

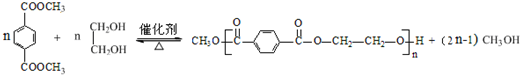 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑤ | C. | ②③⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
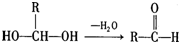 ,请回答下列问题:
,请回答下列问题:
 .
. ;④
;④ .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
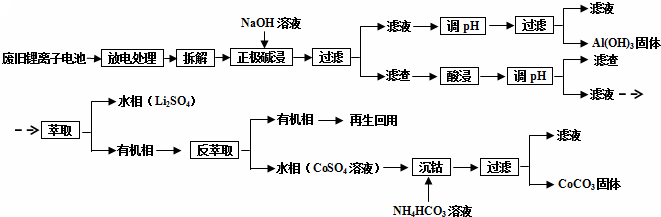
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com