
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的
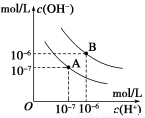
A.A曲线代表25℃时水的电离平衡曲线
B.当95℃时,pH=6的溶液呈中性
C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸
D
【解析】
试题分析:A、A曲线上离子积Kw为10-14(mol?L?1)2,所以A曲线代表25℃时水的电离平衡曲线,正确;B、当95℃时,pH=6时,c(H+)=c(OH?)= 10-6mol?L?1,溶液呈中性,正确;C、10mLpH=12的NaOH溶液中OH-的物质的量为0.0001mol,1mLpH=1的H2SO4 溶液中H+的物质的量为0.0001mol,恰好完全反应,所得溶液的pH=7,正确;D、95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,反应后的溶液呈中性,说明HA为强酸,错误。
考点:本题考查水的电离平衡、酸碱中和反应、酸碱性的判断。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
表中陈述I、II均正确,且两者在反应原理上相似的是( )
选项 | 陈述I | 陈述II |
A | 向酚酞溶液中加Na2O2,溶液先变红后褪色 | 向石蕊溶液中通入Cl2,溶液先变红后褪色 |
B | 将SO2和Cl2同时通入BaCl2溶液中,产生白色沉淀 | 将CO2和NH3同时通入CaCl2溶液中,产生白色沉淀 |
C | 向MgCl2溶液中加入NaOH溶液生成白色沉淀 | 向FeCl3溶液中加入NaOH溶液生成红褐色沉淀 |
D | Na投入水中产生大量气泡 | Na2CO3投入盐酸中产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SiO2是酸性氧化物 | 用盐酸刻蚀石英制品 |
B | 氯化钠熔点很高 | 电解熔融氯化钠制备钠 |
C | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |
D | 硬铝是合金材料 | 硬铝在空气中生成致密氧化膜 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq)  I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
(3)为探究Fe2+ 对O3氧化I-反应的影响(反应体如左图),某研究小组测定两组实验中I3-浓度和体系pH,结果见右图和下表。
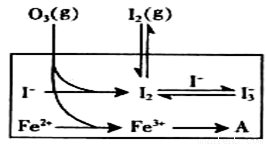

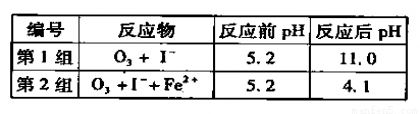
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.“雨后彩虹”是一种自然现象,与胶体的知识有关
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.“通风橱”是一种负责任的防污染手段,可使有害气体得到转化或吸收
D.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的C02反应使瓶内气体减少形成“负压”之故
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z)
B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应
C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z
D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
利用下图装置进行实验,甲乙两池均为l mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是

A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,A电极发生氧化反应
D.断开K1,闭合K2后,NO3-向B电极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;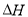 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;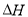 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;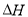 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);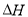 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率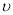 ( A2)为 。
( A2)为 。
②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
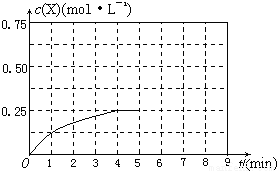
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酿酒过程中,葡萄糖可通过水解反应生成酒精
B.鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解
C.酸性高锰酸钾紫色溶液中加入植物油充分振荡后,溶液颜色会褪去
D.维生素C (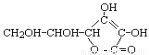 )溶液中滴加KI淀粉溶液,立即变蓝色
)溶液中滴加KI淀粉溶液,立即变蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com