【三选一—物质结构与性质】
Ⅰ.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
⑴当n=2时,AB2属于_______分子(填“极性”或“非极性”),分子中有_______个π键。A6H6分子中A原子的杂化轨道类型是_______杂化。
⑵当n=3时,A与B形成的晶体属于_______晶体。
⑶若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
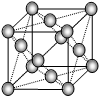
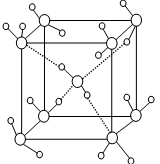
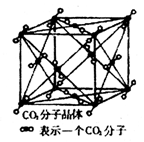
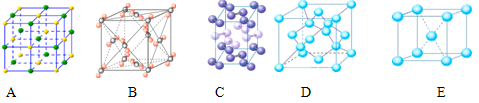
Ⅱ.⑴下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__________(请用相应的编号填写)
⑵①与N
2O互为等电子体的阴离子为______________(填一种即可);②根据价层电子对互斥模型确定ClO
3-离子的空间构型为______________。
⑶已知某红紫色配合物的组成为CoCl
3·5NH
3·H
2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为___________。
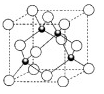
⑷下图是金属铝晶体结构的示意图。已知金属铝的密度为2.7g/cm
3,则紧邻的铝原子的半径为_____________cm。(已知
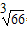
=4.04)

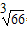 =4.04)
=4.04)