
| A. | 加热溶有SO2的品红溶液 | |
| B. | 将HCl通入NaAlO2溶液中 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸 | |
| D. | 向碳酸氢钠溶液中滴加氢氧化钠溶液 |
分析 A.二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,受热易恢复原色;
B.HCl通入偏铝酸钠溶液中先生成氢氧化铝沉淀,当HCl过量时,沉淀会溶解;
C.酸性条件下,亚铁离子能被硝酸根离子氧化;
D.碳酸氢钠、NaOH、碳酸钠溶液都呈无色.
解答 解:A.二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,受热易恢复原色,所以加热溶有SO2的品红溶液,溶液由无色变为红色,故A不选;
B.HCl通入偏铝酸钠溶液中先生成氢氧化铝沉淀,当HCl过量时,沉淀会溶解,所以看到的现象是:先生成沉淀后沉淀溶解,有明显现象,故B不选;
C.酸性条件下,亚铁离子能被硝酸根离子氧化生成铁离子,同时生成NO,溶液由浅绿色变为黄色,有明显现象,故C不选;
D.碳酸氢钠、NaOH、碳酸钠溶液都呈无色,碳酸氢钠和NaOH反应生成碳酸钠,反应前后溶液都呈无色,没有明显现象,故D选;
故选D.
点评 本题考查元素化合物性质,涉及二氧化硫漂白性、氢氧化铝两性、亚铁离子的还原性等知识点,为高频考点,易错选项是C,中性条件下硝酸根离子没有氧化性,为易错点.


科目:高中化学 来源: 题型:解答题


 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;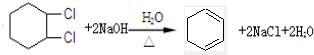 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(秒) | 0 | 500 | 1000 |
| N2O5浓度mol•L-1 | 5.00 | 3.50 | 2.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量不是1mol | B. | 含的氧原子个数为1mol | ||
| C. | 质子数是2mol | D. | 氧分子个数为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| B. | SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 | |
| C. | FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 理由 | 结论 |
| A | 相同物质的量浓度溶液的pH: Ca(ClO)2>CH3COONa | 酸性:CH3COOH>HClO |
| B | 同体积相同pH的盐酸和醋酸与相同的锌 反应的速率:醋酸>盐酸 | 酸性:HCl>CH3COOH |
| C | 相同条件下的沸点: H2O>NH3 | 非金属性:O>N |
| D | 相同物质的量得到电子的数目: 稀硝酸>浓硝酸 | 氧化性:稀硝酸>浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 | |
| C. | 酒精灯不慎着火,应立即吹熄 | |
| D. | 眼睛里溅进盐酸,立即用NaOH溶液洗涤眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com