
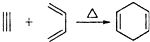 ,如果要合成
,如果要合成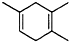 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 只有① | B. | ②③ | C. | ②④ | D. | ①④ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程I反应:2NH4HCO3+Na2SO4═2NaHCO3↓+(NH4)2SO4 | |
| B. | 检验溶液B中阴离子的试剂仅需BaCl2溶液 | |
| C. | 若省略过程II则铵明矾产率明显减小 | |
| D. | 向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi元素位于元素周期表第六周期第VA族 | |
| D. | Bi为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热比C(s)的燃烧热大 | |
| B. | △H4>△H3>△H2>△H1 | |
| C. | CO(g)具有的能量比CO2(g)高 | |
| D. | 1 mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
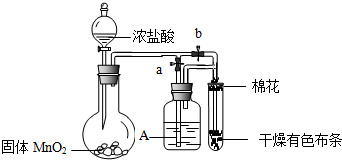
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为
(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为 ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com