
【题目】反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15mol/(L·s) ②v(B)=0.36mol/(L·s)③v(C)=0.4mol/(L·s) ④v(D)=0.45mol/(L·s)该反应进行的快慢顺序为
A. ②>③=④>① B. ④>③>②>①
C. ②>④>③>① D. ④>③>①>②
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
Ⅰ.煤制天然气时会发生多个反应,生产过程中有多种途径生产CH4。
已知:
① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g)![]() CH4(g)ΔH=-73kJ·mol-1
CH4(g)ΔH=-73kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g)ΔH=-171kJ·mol-1
C(s)+CO2(g)ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式____________________。
Ⅱ.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液(滴有几滴酚酞)电解实验,如图所示:
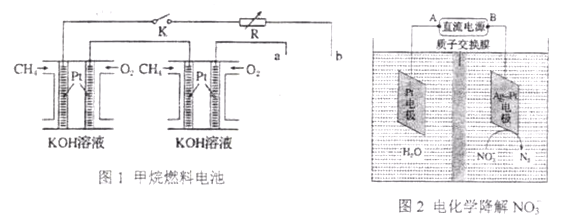
回答下列问题:
(1)①用甲烷燃料电池作为电化学降解NO3-装置的直流电源时,应将A与_____相连(填a或b,下同)B与_____相连。阴极反应式为_____________。
②若电解过程中转移了2mol电子,则膜的两侧电解液的质量变化差(Δm左- Δm右)为________g。
(2)甲烷燃料电池正极、负极的电极反应分别为________ 、_________。
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则图二电解池中理论上Pt最多能产生的氯气体积为________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是

A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是 ( )
①a=b-2;②a+b=8;③a+b=30;④a=b+8
A. ①②③④ B. ②③④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO47H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO47H2O易溶于水,难溶于乙醇。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中滴入酸性KMnO4溶液可发生如下反应,完成该反应的离子方程式:____Fe2++___AsO33-+___MnO4-+___□=___Mn2++___FeAsO4↓+___□,
_________________________,判断该滴定终点的现象是_____________________________________。
(3)流程中②调节pH时可以选用的试剂为__________,滤渣Ⅱ的主要成份为________。
(4)制得的ZnSO47H2O需洗涤,洗涤晶体时可选用试剂为(________)。
A.水 B.乙醇 C. 饱和硫酸锌溶液 D.稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列不正确的是
A. 离子半径:Na+>Mg2+>Al3+>F—
B. 热稳定性:HCl>H2S>PH3
C. 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4
D. 熔点:SiO2>NaCl>Na>CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种溶液中:①pH值为0的盐酸;②0.lmol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为
A. 0:1: 12:11 B. 14:13:12:11
C. 14:13:2:3 D. 1:10:100:1000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取5.48gNa2CO3和NaHCO3的混合物溶于水配成200mL溶液,将溶液分成两等份。
(1)往其中一份溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100mol/L(混合溶液体积改变忽略不计)。
①发生反应的离子方程式为_______________。
②n(Na2CO3)=______mol;n(NaHCO3)=______mol。
(2)往另一份溶液中缓慢滴加0.100mol/L盐酸,请将产生二氧化碳气体的体积(标准状况下且不考虑CO2在水中的溶解)随滴加盐酸的体积变化的曲线绘制在坐标系中。______
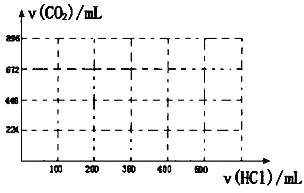
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程 .
(2)Cm﹣、E(m﹣1)﹣的还原性强弱顺序为: , (用离子符号表示)能证明其还原性强弱的离子方程式为 .
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为: .
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式 . 该溶液的溶质含有的化学键类型是 .
(5)HmD和 HmC沸点较高的是(填化学式),原因是 .
(6)在A、B、C、E单质中,符合下列转化关系的是(填元素符号). 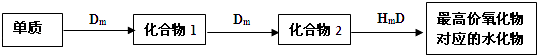
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com