
| A. | 小于0.45 mol | B. | 等于0.45 mol | ||
| C. | 在0.45 mol和0.90 mol之间 | D. | 大于0.90 mol |
分析 浓硫酸与铜反应,随着反应的进行,浓硫酸变稀,稀硫酸与铜不反应,浓硫酸与铜反应时被还原的H2SO4为参加反应的浓硫酸的一半.
解答 解:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,
则50mL 18mol/LH2SO4溶液中加入足量的铜片并加热后被还原的硫酸的物质的量应为:小于0.45mol.
故选:A.
点评 本题考查了浓硫酸与Cu的反应,注意把握浓硫酸与稀硫酸性质的差别,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 温度 | 20℃ | 40℃ | 60℃ | 100℃ |
| 溶解度(s) | 5.0g | 8.7g | 14.8g | 40.2g |
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| pH | 3.0 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能是Z+1或Z+11或Z+25 | B. | 只有Z+1 | ||
| C. | 可能是Z+1或Z+11 | D. | 可能是Z+2或Z+8或Z+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯和环丙烷的混合物中总原子数为3NA | |
| B. | 标准状况下,2.24L苯中约含有0.6NA个碳原子 | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 1 mol  分子中含碳碳双键数为3NA 分子中含碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(X2)=0.2 mol/L | B. | c(Y2)=0.1 mol/L | C. | c(Z2)=0.4 mol/L | D. | c(Y2)=0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与铝合金-比较硬度 | B. | 用水区别氯化钠和硝酸铵固体 | ||
| C. | 用燃烧的方法区别羊毛和涤纶 | D. | 用燃着的木条鉴别氮气与二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式 | D. | 苯的分子式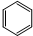 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com