
分析 Cu2+、Mg2+、Fe2+和Al3+四种离子,加碱均转化为沉淀,但生成的氢氧化亚铁被氧化为氢氧化铁,氢氧化铝继续与碱反应生成偏铝酸钠,然后加过量酸,生成Cu2+、Mg2+、Fe3+和Al3+四种离子,据此判断大量减少的阳离子并写出反应的离子方程式、化学方程式.
解答 解:Cu2+、Mg2+、Fe2+和Al3+四种离子,加碱均转化为沉淀,但生成的氢氧化亚铁被氧化为氢氧化铁,氢氧化铝继续与碱反应生成偏铝酸钠,然后加过量酸,生成Cu2+、Mg2+、Fe3+和Al3+四种离子,发生反应的方程式有:Mg2++2OH-=Mg(OH)2↓、Cu2++2OH-=Cu(OH)2↓、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2═4Fe(OH)3、Al3++4OH-=AlO2-+2H2O、Mg(OH)2+2H+=2H2O+Mg2+、Cu(OH)2+2H+=2H2O+Cu2+、Fe(OH)3+3H+=3H2O+Fe3+、AlO2-+4H+=Al3++2H2O,
所以溶液中大量减少的离子为Fe2+,
故答案为:Fe2+;Mg2++2OH-=Mg(OH)2↓、Cu2++2OH-=Cu(OH)2↓、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2═4Fe(OH)3、Al3++4OH-=AlO2-+2H2O、Mg(OH)2+2H+=2H2O+Mg2+、Cu(OH)2+2H+=2H2O+Cu2+、Fe(OH)3+3H+=3H2O+Fe3+、AlO2-+4H+=Al3++2H2O.
点评 本题考查了常见离子的性质及离子方程式、化学方程式书写,题目难度中等,明确常见离子的性质为解答关键,注意掌握离子方程式、化学方程式的书写原则.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤实验可以据此把胶体、溶液分开 | |
| B. | 胶体和溶液的本质区别是胶体能发生丁达尔现象 | |
| C. | 用渗析的方法净化胶体时,使用半透膜只能让小分子和离子通过 | |
| D. | 胶体带电,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
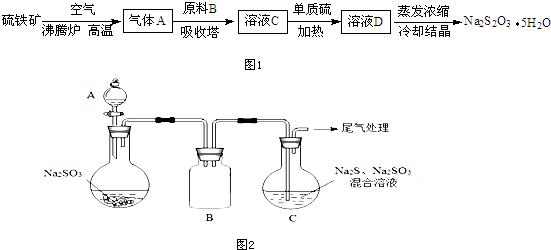
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:
一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18g 16O2中含有NA个氧原子 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 在标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子 | |
| D. | 18O2和16O2化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (D)=0.4 mol•L-1•s-1 | B. | v (C)=0.5 mol•L-1•s-1 | ||
| C. | v (B)=0.6 mol•L-1•s-1 | D. | v (A)=0.15 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③④ | B. | 只有①⑤ | C. | 只有①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com