
分析 (1)从盐类水解的角度和物质的稳定性的角度分析,注意当水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物,固体易受热分解的物质得到分解产物;
(2)Na2CO3水解生成的OH-,能和和玻璃中的SiO2反应生成粘性物质Na2SiO3;
(3)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(4)Al2S3与水发生水解反应生成氢氧化铝、硫化氢.
解答 解:(1)Na2CO3溶液中水解生成碳酸氢钠和氢氧化钠,加热蒸发得到碳酸钠,灼热不分解,最后得到碳酸钠固体;
加热NaHCO3在加热条件下分解生成Na2CO3;
KMnO4在加热条件下易分解生成锰酸钾、二氧化锰和氧气;
AlCl3在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,
故答案为:Na2CO3;Na2CO3;K2MnO4、MnO2;Al2O3;
(2)Na2CO3水解生成的OH-,能和和玻璃中的SiO2反应生成粘性物质Na2SiO3而黏住瓶口,所以不能用玻璃塞试剂瓶盛放碳酸钠溶液,
故答案为:Na2CO3水解生成的OH-能够和玻璃中的SiO2反应,生成的Na2SiO3会粘住瓶口;
(3)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)Al2S3与水发生水解反应,其反应为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑,所以Al2S3固体的制备过程中不能在水溶液中存在,
故答案为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
点评 本题考查盐类水解原理及盐类水解应用,题目难度不大,明确盐的性质及盐类水解原理是解本题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上用FeCl3溶液吸收废气中的H2S气体,离子方程式为:Fe3++H2S=Fe2++S↓+2H+ | |
| B. | 在0.1 mol/L的AlCl3溶液中,Na+、K+、SO42-、HCO3-均可大量共存 | |
| C. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| D. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al比Cu活泼,Al为负极,Cu极上析出NO2 | |
| B. | Cu比Al活泼,Cu为负极,Al极上析出Cu | |
| C. | Cu为负极,电极反应:Cu-2e-═Cu2+ | |
| D. | Al为正极,电极反应:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
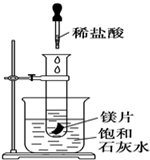 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 6种 | C. | 9种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H<0,△S>0 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ/mol | |
| C. | 铜分别与浓HNO3、稀HNO3反应,还原产物分别为NO2、NO,所以浓HNO3氧化性小于稀HNO3 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
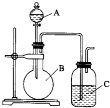 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com