
| A、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| B、海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 |
| C、生铁在潮湿的空气中易生锈,其负极反应式为:2H2O+O2+4e-=4OH- |
| D、BaSO4在医学上用做钡餐,Ba2+对人体无毒 |


科目:高中化学 来源: 题型:
| A、用食醋可除去热水壶内壁的水垢 |
| B、合成纤维和光导纤维都是新型无机非金属材料 |
| C、酒精能使蛋白质变性,可用于杀菌消毒 |
| D、白酒用于增稠增香的塑化剂邻苯二甲酸二丁酯不溶于水,有毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、用98%的浓硫酸代替稀硫酸 |
| C、滴加少量硫酸铜溶液 |
| D、不用铁片改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验时手掌不小心沾上苯酚,应立即用65℃以上的热水清洗防腐蚀 |
| B、检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| C、实验室可以用浓硫酸与氯化钠固体共热制取氯化氢气体,因此浓硫酸与碘化钠固体共热也能制取碘化氢气体 |
| D、用化学方法检验甘油和酒精:可用新制的Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中只存在离子键,没有共价键 |
| B、构成单质分子的粒子中一定含有共价键 |
| C、共价化合物分子中一定不存在离子键 |
| D、仅由非金属元素组成的化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
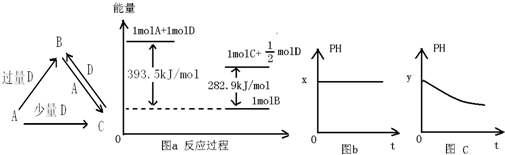
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com