
| A、CH3COOH |
| B、CH3COO- |
| C、H+ |
| D、OH- |
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸钠与石灰水反应:Ca2++CO32-?=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、448mL |
| B、672mL |
| C、896mL |
| D、224mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol?L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.6g |
| B、12g |
| C、6g |
| D、3.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12L氧气 |
| B、1.12L氢气 |
| C、2.24L氢气 |
| D、2.24L氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
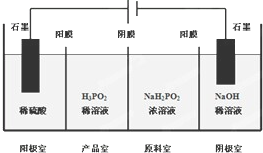 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
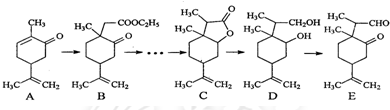
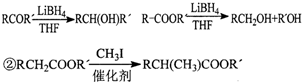
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、[H+]和[OH-]的乘积 | ||
| D、OH-的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com