
| A. | 原子序数 d>c>b>a | B. | 原子半径 A>B>D>C | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属.
A.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,所以原子序数:a>b>d>c,故A错误;
B.A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:B>A>C>D,故B错误;
C.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C3->D->B+>A2+,故C正确;
D.A、B处于同一周期,A、B形成阳离子,则A、B为金属,原子序数A>B,单质还原性B>A,C、D处于同一周期,C、D形成阴离子,则C、D为非金属,原子序数D>C,单质氧化性D>C,故D错误,
故选:C.
点评 本题考查位置结构性质关系及应用,根据核外电子排布确定元素所在周期表中的位置,理解掌握元素周期律的递变规律,难度不大,注意由于是短周期元素,可以确定具体的元素.


科目:高中化学 来源: 题型:选择题
| A. | 0.050 mol | B. | 0.060 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸乙酯 | B. | 甲酸 | C. | 乙酸 | D. | 乙酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
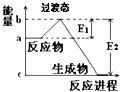 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子 | |
| D. | NH4+为正四面体结构,可推测 PH4+ 也为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
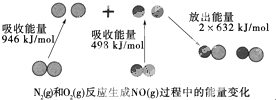 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
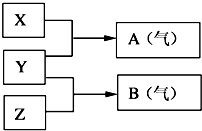 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.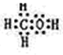 .
.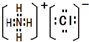 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com