
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
分析 A.二氧化硫具有还原性,且可杀菌消毒;
B.PM2.5颗粒直径大于100nm;
C.四氯化碳不燃烧;
D.高分子化合物的相对分子质量在10000以上.
解答 解:A.二氧化硫具有还原性,金额起到抗优化的作用,可使蛋白质变性,可起到杀菌消毒的作用,故A正确;
B.PM2.5颗粒直径大于100nm,不属于胶体,不具有丁达尔效应,故B错误;
C.四氯化碳中C的化合价为最高价态,不燃烧,故C错误;
D.油脂相对分子质量较小,不是高分子化合物,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的性质以及应用,为高频考点和常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:实验题
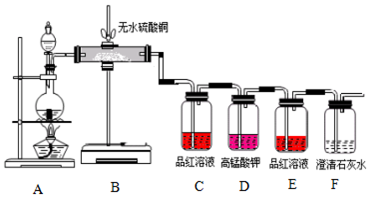
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
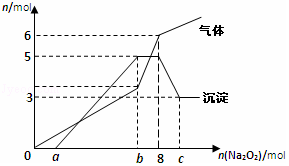 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )| A. | 2mol、3mol、6mol | B. | 3mol、2mol、6mol | C. | 2mol、3mol、4mol | D. | 3mol、2mol、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
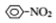 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$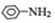 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化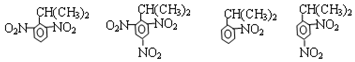 (写出一种的结构简式).
(写出一种的结构简式). .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
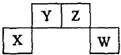 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.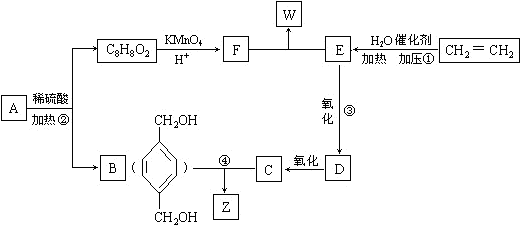
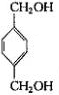 +2CH3COOH$\stackrel{浓硫酸}{→}$
+2CH3COOH$\stackrel{浓硫酸}{→}$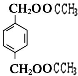 +2H2O.
+2H2O.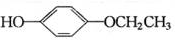 、
、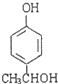 、
、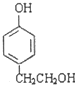 、
、 (任写两种)
(任写两种)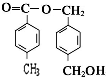 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com