
 n(NaOH)=
n(NaOH)= ×0.5L×2mol/L=0.5mol,
×0.5L×2mol/L=0.5mol, =1mol/L.
=1mol/L.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:013
27.2g铁粉和氧化铁的混合物放入500mL的稀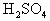 中发现固体完全溶解并放出4.48L
中发现固体完全溶解并放出4.48L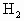 (标准状况),加入
(标准状况),加入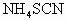 后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
[ ]
查看答案和解析>>
科目:高中化学 来源:高中化学同步单元练习册 全册 高二年级 题型:013
27.2g铁粉和氧化铁的混合物放入500mL的稀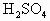 中发现固体完全溶解并放出4.48L
中发现固体完全溶解并放出4.48L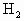 (标准状况),加入
(标准状况),加入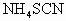 后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com