
下列说法不正确的是( )
A.欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末
B.形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物
C
【解析】
试题分析:A.氯水中盐酸与碳酸钙反应,可使氯气与水的化学平衡正向移动,则提高氯水中HClO的浓度可往氯水中加适量的碳酸钙粉末,故A正确;B.形成酸雨的氧化物主要是SO2和氮的氧化物,与水反应生成酸使pH<5.6;温室效应与二氧化碳有关,使全球温度升高,故B正确;C.水晶项链的主要成分是二氧化硅,故C错误;D.由N2+O2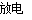 2NO,2NO+O2=2NO2,4NO+3O2+2H2O=4HNO3,,FeS2煅烧转化为SO2可知,大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物,故D正确;故选C。
2NO,2NO+O2=2NO2,4NO+3O2+2H2O=4HNO3,,FeS2煅烧转化为SO2可知,大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物,故D正确;故选C。
考点:考查物质的性质,综合考查元素化合物知识


科目:高中化学 来源:2015届辽宁省高二上学期期中考试化学试卷(解析版) 题型:填空题
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示。

(1)饱和H2S溶液中存在 种微粒。
(2)若将容器顶盖由a压到b位置,则H2S溶液中,各离子浓度的变化情况是________离子浓度增大,而________离子浓度减小。
(3)若从c处不断通入过量的SO2气体,溶液中H+浓度将 。
A.不断增大 B.先减小,后增大到某值 C.不变 D.先增大,后减小到某值
(4)若由c处不断通入N2,则溶液中H+浓度将________。(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
在同温、同压下,A容器的氨气和B容器的氯气中,若它们所含的原子数相等,则这两个容器的体积之比是
A.2∶1 B.1∶2 C.2∶3 D.1∶3
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3?H2O+H2O
B工业上用石灰乳制漂粉精:2OH- + Cl2 =Ca2+ + Cl- + ClO- + H2O
C.向漂白粉溶液中通入一定量的SO2:Ca2+ + 3ClO- +SO2 + H2O=CaSO4 +Cl- +2HClO
D.向100mL 0.1mol/L NaOH溶液中滴入数滴0.2mol/L Ca(HCO3)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是 ( )
A.Cs显+3价,I 、Cl 均显-1价
B.Cs显 +1价,Cl显+1价,I显-1价、
C.在CsICl2溶液中通入Cl2 ,有单质碘生成
D.在CsICl2溶液中通入SO2气体,有硫酸生成
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
有Fe2+、NO—3、Fe3+、NH+4、H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.氧化剂与还原剂的物质的量之比为8:l
B.若有l mol NO—3参加还原反应,则转移8mol e-
C.还原产物为NH+4
D.若把该反应设计为原电池,则负极反应为Fe2+—e—=Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
Na2SO4溶液的溶解度曲线如图,下列说法一定正确的是( )
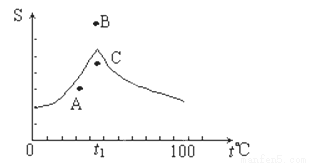
A.A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4·H2O晶体都可使其饱和
B.B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度
C.在C点时Na2SO4溶液降温或升温,都会使其溶液变澄清
D.制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:推断题
已知下图中物质M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,阴离子元素最高正价与它的负价代数和为6。X具有漂白性,Y为碱性气体, W是对空气无污染的气体。试回答下列问题:

(1)写出电解M溶液①的化学方程式 。
(2)写出实验室制取Y气体的化学方程式 。
(3)若A是一种常见金属,写出反应②的化学方程式 。
(4)若A是某元素的一种常见酸性氧化物,写出反应③的离子方程式 。
(5)写出X的电子式 和Z的结构式 。
(6)写出反应⑤的化学方程式 。
(7)标准状况下反应⑥中生成11.2L W时转移的电子数 。(用NA表示阿佛加德罗常数)
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(10分)海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_____________(填序号);
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)下图是从海水中提取镁的简单流程。

工业上常用于沉淀 Mg2+的试剂A的名称是__________,,Mg(OH)2转化为MgCl2离子方程是_________海水经蒸发浓缩析出NaCl晶体后的溶液成为卤水,卤水中含有NaBr等无机盐,某实验小组同学设计如下实验流程,模拟工业上从卤水提取工业溴。

①操作I中所涉及到的离子反应方程式为____________.
操作II中所涉及到的化学反应方程式为____________.
②操作II用SO2水溶液吸收Br2,吸收率可达95%,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_____________.
③实验小组的同学通过实验发现,如果用未经浓缩的海水直接与Cl2反应,生成的Br2的量会大幅度降低,请你根据所学知识分析原因:_______________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com