
 H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).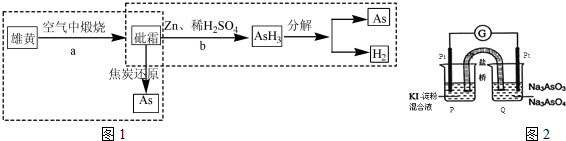
分析 (1)化合物中H为+1价,O为-2价,根据正负化合价代数和为0计算As的化合价;H3AsO3是两性偏酸性的化合物,与硫酸反应时应生成盐和水,据此发生反应的化学方程式为2H3AsO3+3H2SO4=As2(SO4)3+6H2O;Na2HAsO3溶液呈碱性,是HAsO32-在溶液里水解生成H3AsO3的缘故;
(2)雄黄As4S4在空气中燃烧生成SO2和砒霜(As2O3),其中SO2对环境有污染,主要体现在酸雨上;砒霜(As2O3)和Zn一起溶解在稀硫酸中生成AH3和硫酸锌,再将AsH3加热使之分解生成As和氢气;
①反应a生成的SO2是造成酸雨的污染性气体;砒霜(As2O3)和Zn一起溶解在稀硫酸中生成AH3和硫酸锌,可结合原子守恒和电子守恒写出此反应的化学方程式;
②雌黄As2S3可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,此反应中还原剂为As2S3,对应的氧化产物为H3AsO4与S,硝酸为氧化剂对应的还原产物为NO,可根据电子守恒计算还原剂和氧化剂的物质的量之比;
③根据溶度积的计算公式,可计算当As3+完全沉淀时溶液里s2-浓度,再根据Ksp(FeS)计算此时Fe2+的浓度;
(3)某原电池装置如图2,电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH.当P池中溶液由无色变成蓝色时,说明P池发生的是负极氧化反应,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,据此可写出电极反应方程式,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,电子应由负极流向正极.
解答 解:(1)化合物H3AsO3中H为+1价,O为-2价,含As为x价,则(+1)×3+x+(-2×3)=0解得:x=+3;H3AsO3是两性偏酸性的化合物,与硫酸反应化学方程式为2H3AsO3+3H2SO4=As2(SO4)3+6H2O,所得盐的化学式为As2(SO4)3;Na2HAsO3溶液呈碱性,是由于发生水解HAsO32-+H2O H2AsO3-+OH-大于其电离HAsO32- AsO33-+H+的原因,且溶液中c(H2AsO3-)>c(AsO33-);
故答案为:+3;As2(SO4)3;HAsO32-+H2O  H2AsO3-+OH-;>;
H2AsO3-+OH-;>;
(2)雄黄As4S4在空气中燃烧生成SO2和砒霜(As2O3),其中SO2对环境有污染,主要体现在酸雨上;砒霜(As2O3)和Zn一起溶解在稀硫酸中生成AH3和硫酸锌,再将AsH3加热使之分解生成As和氢气;
①SO2易造成硫酸酸雨;砒霜(As2O3)和Zn一起溶解在稀硫酸中生成AH3和硫酸锌,此反应的化学方程式为As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
故答案为:造成硫酸酸雨;As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
②每摩尔As2S3氧化为H3AsO4与S时转移电子数为[(5-3)×2+2×3]mol=10mol,每摩硝酸还原为NO2时转移电子为(5-4)mol=1mol,根据电子守恒可知还原剂和氧化剂的物质的量之比为1:10,故答案为:1:10;
③已知Ksp(As2S3)=1×10-22=c2(As3+)×c3(s2-),其中c(As3+)=1×10-5mol/L,解得:c(s2-)=1×10-4mol/L,此时Ksp(FeS)=c(Fe2+)×c(s2-)=6×10-18,解得:c(Fe2+)=6×10-14mol/L;
故答案为:6×10-14;
(3)P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出,故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
点评 本题以As及其化合物的性质为研究对象,考查综合,涉及水解平衡与电离平衡、氧化还原反应的分析与计算、原电池原理及平衡的移动、溶度积的计算等,属基础考查,难度中等,对提高学生分析问题解决问题的能力培养有一定帮助.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
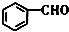 的名称是苯甲醛.
的名称是苯甲醛.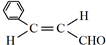 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
.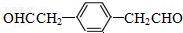 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
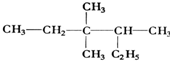 3,3,4-三甲基己烷
3,3,4-三甲基己烷 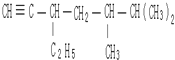 5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔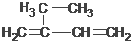 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯 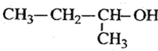 2-丁醇
2-丁醇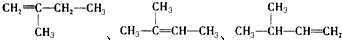 .
.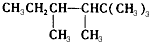 ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
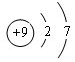 .
.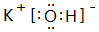 ;其中所含化学键的类型离子键、共价键.
;其中所含化学键的类型离子键、共价键.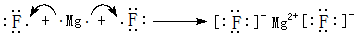 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
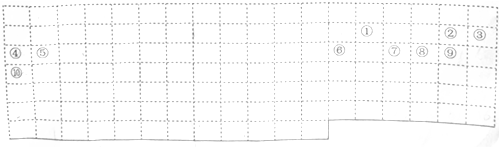
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
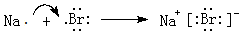 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com