
【题目】冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图,下列有关冰晶胞说法正确的是( )
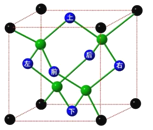
A. 冰晶胞内水分子间以共价键结合
B. 每个冰晶胞平均含有4个水分子
C. 水分子间的氢键具有方向性和饱和性,也是σ键的一种
D. 实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入CO、CH4、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A. p(CO)>p(CH4)>p(O2) B. p(O2)>p(CO)>p(CH4)
C. p(CH4)>p(O2)>p(CO) D. p(CH4)>p(CO)>p(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化得CO和H2,在催化剂存在条件下进一步合成甲醇(反应I),并同时发生反 应II.
I.CO(g)+2H2(g) ![]() CH3OH(g) △H1 = -81 kJ mol-1
CH3OH(g) △H1 = -81 kJ mol-1
II. CO(g)+H2(g) ![]() C(s)+H2O (g) △H2
C(s)+H2O (g) △H2
已知:①2C(s)+O2(g)=2CO(g) △H3 =-221 kJ mol-1
② H2O(g)=H2O(1) △H4 =-44.0 kJ mol-1
③H2的标准燃烧热为285. 8 kJ mol-1
④反应过程中催化剂对选择性会产生影响,甲醇选择性是指转化的CO中生成甲醇的百分比。
请回答:
(1)反应 II 中△H2 =______ kJ mol-1
(2)为减弱副反应II的发生,下列采取的措施合理的是_________。
A.反应前加入少量的水蒸气 B.增压
C.降低反应温度 D.使用合适催化剂,平衡前提高甲醇的选择性
(3)在常压下,CO和H2的起始加入量为10 mol、14 mol,容器体积为10 L.选用Cu/NiO催化剂,升高温度在450℃时测得甲醇的选择性为80%,CO的转化率与温度的关系如图所示,则此温度下反应I的平衡常数K=_______,并说明CO的转化率随温度升高先增大后减小的原因:____________。

(4)350℃时甲醇的选择性为90%,其他条件不变,画出350℃时甲醇的物质的量随时间的变化曲线。_________________
(5)甲醇燃料电池由甲醇电极、氧电极和质子交换膜构成,写出负极的电极反应式:_________。实验证明CO在酸性介质中可电解产生甲醇,写出阴极的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,相同体积的甲、乙两种气体的质量比是17∶14。若乙气体是CO,则甲气体可能是( )
A. H2S B. HCl C. NH3 D. Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的哑铃形![]() 的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
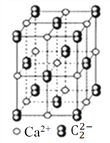
A. 1个Ca2+周围距离最近且等距离的![]() 数目为6
数目为6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4克CaC2晶体中含阴离子0.lmol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A. SO2有漂白性,可广泛用于食品增白工业
B. 浓硫酸不能与Al反应,故可用铝槽车运送浓硫酸
C. 14C可用于文物年代鉴定,14C与12C互为同位素
D. 从海水中提取的所有物质都须通过化学反应才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 碳酸钡溶于醋酸:BaCO3+2H+===Ba2++H2O+CO2↑
C. 金属钠跟水反应:2Na+2H2O===2Na++2OH-+H2↑
D. 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. NaHCO3与NaOH溶液反应:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
B. 氢氧化铜溶液与硫酸反应:OH-+H+===H2O
C. 氯化铁溶液中加入足量的氨水:Fe3++3NH3·H2O===Fe(OH)3 ↓+3NH![]()
D. 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-===SiO![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com