
在密闭容器中,对于可逆反应A+3B 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
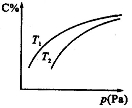
A.若正反应方向ΔH<0,则T1>T2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定为气体
D.A一定为气体
C
【解析】
试题分析:A.若正反应方向ΔH<0,则在相同的压强下由于C% T1>T2,根据平衡移动原理:降低温度,平衡向放热反应方向移动。正反应方向为放热反应。所以T1<T2。错误。B.压强增大时,平衡向气体体积减小的方向移动。由于在反应前后气体的质量不变,所以混合气体的平均相对分子质量增大。错误。C.因为在相同的温度下,增大压强,C% 增大。即平衡正向移动。根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。正反应方向为气体体积减小的方向,所以B一定为气体。正确。D.在相同的温度下,增大压强,C% 增大。即平衡正向移动。根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。正反应方向为气体体积减小的方向,因为C的系数是2,B的系数是3,所以B一定为气体,而A可能为气体,也可能不是气体,结果都相同。因此该选项错误。
考点:考查温度和压强对化学平衡的移动的影响的知识。


科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
下列结论正确的是 ( )
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
A.①④⑤ B.③⑥ C.②④⑤⑥ D.①③④
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl。以下对铊的单质及其化合物的性质推断中,不正确的是( )
A、铊是易导电的银白色金属 B、铊能生成+3价的离子
C、Tl3+的氧化能力比Al3+强 D、氢氧化铊的碱性比氢氧化铝强
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
有八种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦邻二甲苯、
⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是
A.③④⑤⑧ B.④⑤⑧ C.④⑤⑦⑧ D.③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li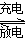 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。
下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性 B.放电时Li+向负极移动
C.充电过程中,电池正极材料的质量减少 D.放电时电池正极反应为:Li-e-=== Li+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
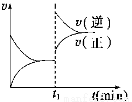
A.2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g) 2HI(g) ΔH>0
2HI(g) ΔH>0
D.2A(g)+B(s) 2C(g) ΔH>0
2C(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:推断题
(13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) |
探究①A. B.向pH=2的硫酸中滴加Na2S2O3溶液 | a.溶液pH=8 b. | i. ii. S2O32-+2H |
探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii. |
【实验结论】探究① 探究② 。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质 。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由: 。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的表示及说法正确的是( )
A.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定
B.已知I2(g)+H2(g)=2HI(g) △H1;I2(s)+H2(g)=2HI(g) △H2;
则△H1<△H2
C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
已知在一定条件下, 2SO2+O2 2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
A. 大于45.3% B. 小于45.3% C. 等于45.3% D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com