

| A. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| B. | Z位于元素周期表中第二周期,第ⅥA族 | |
| C. | X的气态氢化物的稳定性比Z的弱 | |
| D. | M的原子半径比Y的原子半径大 |
分析 由四种短周期元素在元素周期表中的位置,可知Y、Z处于第二周期,M、X处于第三周期,其中只有一种为金属元素,只能是M为金属,则M为Al,可推知X为Si,Y为N,Z为O.
A.非金属性越强,最高价含氧酸的酸性越强;
B.氧元素处于第二周期VIA族;
C.非金属性越强,对应氢化物越稳定,
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大.
解答 解:由四种短周期元素在元素周期表中的位置,可知Y、Z处于第二周期,M、X处于第三周期,其中只有一种为金属元素,只能是M为金属,则M为Al,可推知X为Si,Y为N,Z为O.
A.非金属性越强,最高价含氧酸的酸性越强,而非金属性N>Si,故酸性:硝酸>硅酸,故A错误;
B.氧元素处于第二周期VIA族,故B正确;
C.非金属性Si<N,氢化物稳定性与非金属性一致,故C正确;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径M>X,故D正确.
故选:A.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表与元素周期律,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
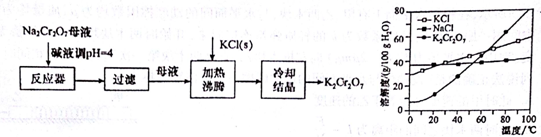
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
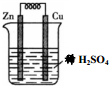
| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
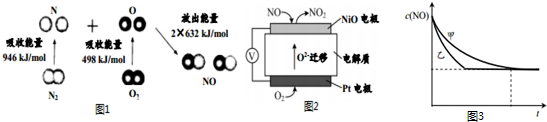
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
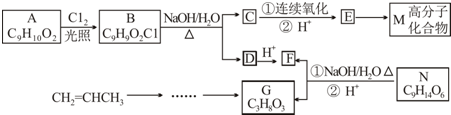
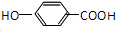 .
. .
.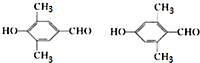 .
.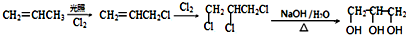 . (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
. (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com