
A.1,2 B.0,1,2 C.1,2,3 D.0,+1,-1
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:阅读理解
1.《有机化学基础》
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,可用于制头盔、防弹背心和刚性前后防护板。下图是有关M5纤维等有机物的转化关系图(部分反应未注明条件):
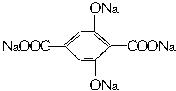
请回答:
(1)写出下列物质的结构简式F____________,H____________。B的氢的核磁共振谱图中有____________种类型的氢原子吸收峰。
(2)1 mol G与Na2CO3溶液反应,最多消耗Na2CO3____________ mol。
(3)指出下列反应的反应类型:A→B____________;G→M5____________。
(4)写出C→D反应的化学方程式:____________________________________________。
(5)试分析M5纤维具有极高强度的原因:_______________________________________。
2.《物质结构与性质》
有A、B、C、D、E原子序数均为前20号的五种元素,其中A元素和B元素的原子都有1个未成对电子,A+与B-具有相同的电子层结构,B原子得一个电子后2p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数。R是由A、D两元素形成的化合物;E元素原子中4s能级有2个电子。请回答:
(1)A单质、B单质、化合物R的熔点大小顺序为____________(填序号)。
①A单质>B单质>化合物R ②化合物R>A单质>B单质
③A单质>化合物R>B单质 ④B单质>化合物R>A单质
(2)B-的特征电子排布式为____________;在CB3分子中C元素原子的原子轨道发生的是____________杂化,其固态时的晶体类型为____________。
(3)C的氢化物的空间构型为____________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是____________________________________________________________________。
(4)B、C、D三元素的电负性大小顺序为____________>____________>____________(填元素符号)。
(5)E与B形成的晶体M的最小单元“晶胞”如下图所示,则M的化学式为____________;如果M晶体的密度为d g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的E中心间的距离为____________ cm。
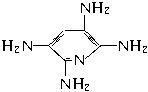
查看答案和解析>>
科目:高中化学 来源:2012届山西省山大附中高三第一次模拟试题理综化学试卷(带解析) 题型:填空题
【化学-物质结构与性质】(15分)
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为 ;在熔点很高的两种常见单质中,X的杂化方式分别为 、 。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第 电离能。
(4)戊的基态原子有 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.161g/L,则在该化合物的分子中A原子的杂化方式为???? 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为?????? (填元素符号)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素的电离能第一次突增应出现在第___电离能。
(4)AC2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于______________晶体.该晶体中A原子轨道的杂化类型为??????? 。
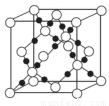
(5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间构型为???????????? 。
(6)C和D形成的一种离子化合物D2C的晶胞结构如图所示.该晶体中阳离子的配位数为?????? 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为????????? 。
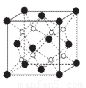
已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.则晶胞边长a=?? cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次模拟试题理综化学试卷(解析版) 题型:填空题
【化学-物质结构与性质】(15分)
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为 ;在熔点很高的两种常见单质中,X的杂化方式分别为 、 。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第 电离能。
(4)戊的基态原子有 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)

(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com