
| A. | 15 mL 1 mol/L 的FeCl3溶液 | |
| B. | 9.5 g MgCl2溶于水配成100 mL 溶液 | |
| C. | 143.5 g AgCl加入到100 mL 水中 | |
| D. | 在含有1.505×1021个Al3+的50 mL的AlCl3溶液 |
分析 根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关.
解答 解:A、15 mL 1 mol/L 的FeCl3溶液中C(Cl-)=3C(FeCl3)=1mol/L×3=3mol/L;
B、9.5 g MgCl2的物质的量为0.1mol,溶于水配成100 mL溶液,其物质的量浓度为1mol/L,C(Cl-)=2C(MgCl2)=1mol/L×2=2mol/L;
C、143.5 g AgCl加入到100 mL 水中,AgCl不溶于水,氯离子浓度为0;
D、1.505×1021个Al3+的物质的量为$\frac{1.505×1{0}^{21}}{6.02×1{0}^{23}}$mol=2.5×10-3mol,则在含有1.505×1021个Al3+的50 mL的AlCl3溶液中氯离子的物质的量为7.5×10-3mol,浓度为$\frac{7.5×1{0}^{-3}mol}{0.05L}$=0.15mol/L,
故选:A.
点评 本题考查了物质的量浓度的有关计算,根据物质的组成以及溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可.


科目:高中化学 来源: 题型:选择题
| A. | 可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应 | |
| B. | 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应 | |
| C. | 对于合成氨的反应,如果调控好反应条件,可使一种反应物的转化率达到100% | |
| D. | 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这两个反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子数的数目为0.1NA | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3列元素种类最多,第14列元素种类也最多 | |
| B. | 第8、9、10三列元素中没有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| B. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 含有0.1mo•L-1的Ca2+溶液:Na+、K+、CO32-、Cl- | |
| D. | 澄清透明的溶液中:Na+、K+、MnO4-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
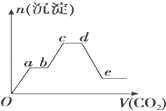 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | ab段与cd段沉淀质量都不变,但所发生的反应不相同 | |
| C. | bc段反应的离子方程式是:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| D. | de段沉淀减少是由于Al(OH)3固体消失的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com