
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
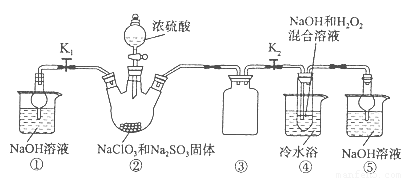
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:??????????????????? 。
(2)装置②中产生ClO2的化学方程式为 ??????????????????????????????? 。
装置④中发生反应的离子方程式为????????????????????????????????? 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②????? ;③????? ;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。
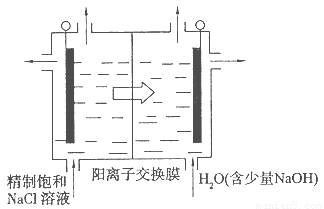
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 ????????????? 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为??? mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是????? ;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为?????????? 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为???????? 。
(1)关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合理答案均得分)
(2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2↑;
(3)趁热过滤;用38℃~60℃温水洗涤;
(4)Cl--5e-+2H2O=ClO2↑+4H+;0.01mol;
(5)溶液由蓝色变为无色且半分钟内不变色;90.5%。
【解析】
试题分析:(1)组装好仪器后,检查整套装置气密性的操作是:关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合理答案均得分)(2)装置②中产生ClO2的反应是氯酸钠、亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化氯和水,化学方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;根据题意知,装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2、H2O和O2,离子方程式为2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2↑;(3)从溶液中得晶体一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2?3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,答案为:趁热过滤;用38℃~60℃温水洗涤;(4)①根据题给装置分析,电解池阳极反应为氯离子失电子生成ClO2,氯元素的化合价由—1价升高到+5价,结合原子守恒和电荷守恒写出,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+②电解池阴极为氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,氢气的物质的量为0.005mol,则放电的氢离子为0.01mol,根据电中性原则通过阳离子交换膜的阳离子为+1价离子的物质的量为0.01mol;(5)根据题意知,配制250mL待测液需用到的定量玻璃仪器是250mL容量瓶;以淀粉溶液做指示剂,碘单质遇淀粉变蓝色,反应结束时,碘反应完全,蓝色褪去,达到滴定终点时的现象为当滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色;根据题给反应ClO2-+4I-+4H+=2H2O+2I2+C1-,I2+2S2O32-=2I-+S4O62-得关系式:NaClO2——4S2O32-,设样品中NaClO2的质量分数为x,则有:
NaClO2——4S2O32-
90.5g 4mol
10xg 2 mol?L-1×0.02L×10
解得x=90.5%。
考点:考查化学实验基本操作、离子方程式的书写、电化学原理及关系式法计算。


科目:高中化学 来源: 题型:
 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
| O | n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化学 来源:2012届福建省三明市普通高中高三上学期联合命题考试化学试卷 题型:填空题
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年贵州省铜仁市高三第四次月考理综化学试卷(解析版) 题型:选择题
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
A.ClO2 B.NaClO4 C.HClO D. NaClO
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省三明市高三上学期联合命题考试化学试卷 题型:填空题
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O
 HCl
+ HClO K=4.5×10-4
HCl
+ HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。

①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com