
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:___。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题
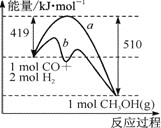
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_______。
②已知CO中的C与O之间为三键,其键能为xkJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。①该电池负极的电极反应式为__。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
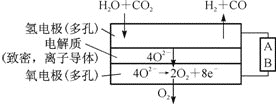
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2,O2穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。
【答案】2CH3OH(g) + O2(g) =2HCHO(g) + 2H2O(g) ΔH= -316 kJ·mol-1 <加入催化剂1097CH3OH-6e- + 8OH- =CO32- + 6H2O3.2 g负极H2O + 2e- = H2↑ + O2-
【解析】
(1)①CH3OH(g)=HCHO(g)+H2(g),②2H2(g)+O2(g)=2H2O(g),2×①+②得出:2CH3OH(g) + O2(g) =2HCHO(g) + 2H2O(g) ΔH= -316 kJ·mol-1;(2)①反应前气体系数之和大于反应后气体系数之和,因此此反应是熵减,即△S<0,a→b活化能降低,因此使用催化剂,催化剂降低活化能;②根据△H和键能的关系,即△H=x+2×436-(3×413+358+463)=(419-510)kJ·mol-1,解得x=1097;(3)①构成的是燃料电池,通氧气一极为正极,通甲醇一极为负极,环境是碱性,OH-参与负极反应,甲醇转化成CO32-和OH-,因此负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;②根据电解原理,Cu2+的放电顺序大于H+,因此第一阶段阴极反应式Cu2++2e-=Cu,Cl-放电顺序大于OH-,因此阳极反应式为2Cl--2e-=Cl2↑,n(Cu2+)=200×10-3×0.5mol=0.1mol,根据转移电子守恒,阳极上失去电子为0.2mol,则消耗n(Cl-)=0.2mol,生成Cl2的物质的量为0.1mol,此时剩余Cl-的物质的量为(200×10-3×2-0.2)mol=0.2mol,两极都收集到气体,第二阶段阴极反应式:2H++2e-=H2↑,假设阳极反应式只有2Cl--2e-=Cl2↑,0.2molCl-全部放电,转移电子物质的量为0.2mol,得到氯气的物质的量为0.1mol,因此阴极上产生氢气的物质的量为0.1mol,阴阳两极产生气体的物质的量不等,阴极上4OH--4e-=O2↑+2H2O,设此时阴极上有xmolH2产生,转移电子为2x,产生氧气物质的量2x/4mol=x/2mol,两极产生气体的物质的量相等,因此有0.1+x=0.2+x/2,解得x=0.2mol,产生氧气的质量为0.2×32/2g=3.2g;(4)根据电解原理,阴离子向阳极移动,因此A为作负极,B为正极,根据示意图,H2O在阴极上得电子,转化成H2和O2-,电极反应式为H2O+2e-=H2↑+O2-。


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】高聚物…—CH2—CH2—CH2—…是用下列何种物质聚合成的( )
A. CH3—CH3 B. CH3—CH2—CH3
C. CH2=CH2 D. CH2=CH—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生如图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为气体混合物,R是一种无色无味能使澄清石灰水变浑浊的气体,C为红褐色沉淀,M为一种常见金属单质。

试回答下列问题:
(1)X的化学式为__________。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的_________(填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列转化的化学方程式:
B→D:____________________;H→C:____________________。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为:___________。
(5)X与浓硝酸在一定条件下反应时,若有1 mol X被氧化时,转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C. ①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物)为原料制备MgCO33H2O。实验过程如下:
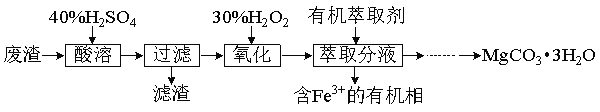
(1)酸溶需加热的目的是 ;过滤时用到的玻璃仪器有 ;
(2)加入H2O2氧化时发生发应的离子方程式为 。
(3)用如图所示的实验装置进行萃取和分液,以除去溶液中的Fe3+。
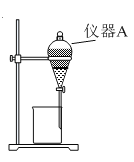
①实验装置图中仪器A的名称为 。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电导率传感器可绘制电导率曲线图,下图为用0.1mol·L-1NaOH溶液滴定10mL,0.1mol·L-1盐酸过程中的电导率曲线。下列说法错误的是

A. 电导率传感器能用于判断酸碱中和滴定的终点
B. 该过程中,a点所示溶液的导电性最强
C. c点电导率最小是因为此时溶液中导电微粒的数目最少
D. d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
选项 | 化学性质 | 实际应用 |
A | SiO2能与碱反应 | 用于制光导纤维 |
B | MnO2具有氧化性 | 用作干电池正极活性材料 |
C | SO2具有还原性 | 用SO2的水溶液吸收溴蒸气 |
D | ClO2具有氧化性 | 用作自来水消毒杀菌剂 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com