
| 编号 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe(OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加入H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.只改变压强一个变量;
B.乙酸乙酯中加入饱和碳酸钠溶液,与乙酸乙酯分层;
C.离子、分子及胶体均可透过滤纸;
D.加入H2O2 后,可氧化亚铁离子,应加CuO调节pH.
解答 解:A.二氧化氮与四氧化二氮存在化学平衡,只改变压强一个变量,则可研究压强对化学平衡移动的影响,故A正确;
B.乙酸乙酯中加入饱和碳酸钠溶液,与乙酸乙酯分层,然后分液可分离,不能蒸馏,故B错误;
C.离子、分子及胶体均可透过滤纸,不能过滤分离,应选渗析法,故C错误;
D.加入H2O2 后,可氧化亚铁离子,应加CuO调节pH,不能加氨水,引入新杂质铵根离子,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握化学平衡移动、混合物的分离提纯、氧化还原反应、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
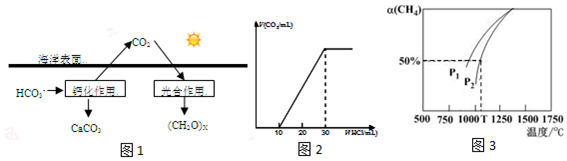
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
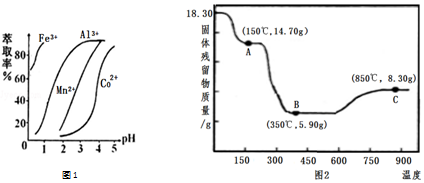
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶液$\stackrel{通入SO_{2}}{→}$白色沉淀 | |
| B. | 无色溶液$\stackrel{稀HNO_{3}}{→}$ $\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| C. | Ba(NO3)2溶液$\stackrel{加过量HCl}{→}$无现象 $\stackrel{Na_{2}SO_{4}}{→}$白色沉淀 | |
| D. | Fe(NO3)2溶液$\stackrel{加过量HCl}{→}$ $\stackrel{通入SO_{2}}{→}$ $\stackrel{BaCl_{2}}{→}$白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>Fe3+>稀硫酸 | |
| C. | 向偏铝酸钠溶液通入少量的二氧化碳,生成白色沉淀和碳酸钠,说明HCO3-和AlO2-不能共存 | |
| D. | 在铝制容器中加入食盐溶液,再将变量的银器浸入该溶液中,一段时间后发现黑色会褪去,是因为银器表面Ag2S和金属铝构成原电池而发生了反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | A | B | C | D |
| 实验装置或 方案 | 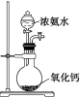 | 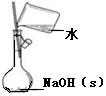 | 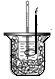 50mL0.5mol/LHCl与50mL0.55mol/LNaOH溶液 |  |
| 目的 | 制备少量氨气 | 配制0.10mol/L NaOH溶液 | 测定中和热 | 探究Ksp(AgCl)与Ksp(AgI)的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| C. | 若开始时开关K与b连接,则该装置是化学能转变为电能 | |
| D. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
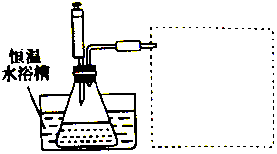 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com