
”¾ĢāÄæ”æĻņBa£ØOH£©2ČÜŅŗÖŠÖšµĪ¼ÓČėĻ”ĮņĖį£¬ĒėĶź³ÉĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³ö·“Ó¦µÄĄė×Ó·½³ĢŹ½ £®
£Ø2£©ĻĀĮŠČżÖÖĒéæöĻĀ£¬Ąė×Ó·½³ĢŹ½Óė£Ø1£©ĻąĶ¬µÄŹĒ £ØĢīŠņŗÅ£©£®
A.ĻņNaHSO4ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮČÜŅŗĻŌÖŠŠŌ
B.ĻņNaHSO4ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮSO ![]() Ē”ŗĆĶźČ«³Įµķ
Ē”ŗĆĶźČ«³Įµķ
C.ĻņNaHSO4ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮ¹żĮæ
£Ø3£©Čō»ŗ»ŗ¼ÓČėĻ”ĮņĖįÖ±ÖĮ¹żĮ棬Õūøö¹ż³ĢÖŠ»ģŗĻČÜŅŗµÄµ¼µēÄÜĮ¦£ØÓƵēĮ÷Ēæ¶ČI±ķŹ¾£©æɽüĖʵŲÓĆĶ¼1ÖŠµÄĒśĻß±ķŹ¾£ØĢīŠņŗÅ£©£® 
£Ø4£©ČōÓŠŅ»±ķĆę¹ā»¬µÄĖÜĮĻŠ”ĒņŠüø”ÓŚBa£ØOH£©2ČÜŅŗÖŠŃė£¬ČēĶ¼2ĖłŹ¾£¬ĻņøĆÉÕ±Ąļ»ŗ»ŗ×¢ČėÓėBa£ØOH£©2ČÜŅŗµČĆܶȵÄĻ”ĮņĖįÖĮĒ”ŗĆĶźČ«·“Ó¦£®ŌŚ“ĖŹµŃé¹ż³ĢÖŠ£¬Š”Ēņ½« £® 
”¾“š°ø”æ
£Ø1£©Ba2++2OH©+SO42©+2H+ØTBaSO4”ż+2H2O
£Ø2£©A
£Ø3£©C
£Ø4£©³Įµ½ÉÕ±µ×²æ
”¾½āĪö”æ½ā£ŗ£Ø1£©·“Ӧɜ³ÉĮņĖį±µŗĶĖ®£¬øĆĄė×Ó·“Ó¦ĪŖBa2++2OH©+SO42©+2H+ØTBaSO4”ż+2H2O£¬¹Ź“š°øĪŖ£ŗBa2++2OH©+SO42©+2H+ØTBaSO4”ż+2H2O£»£Ø2£©Ąė×Ó·½³ĢŹ½£Ø1£©·“Ó¦ŗóČÜŅŗĪŖÖŠŠŌ£¬A£®ĻņNaHSO4ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮČÜŅŗĻŌÖŠŠŌ£¬Ąė×Ó·“Ó¦ĪŖBa2++2OH©+SO42©+2H+ØTBaSO4”ż+2H2O£¬¹ŹAŃ”£» B£®ĻņNaHSO4ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮSO42©Ē”ŗĆĶźČ«³Įµķ£¬Ąė×Ó·“Ó¦ĪŖBa2++OH©+SO42©+H+ØTBaSO4”ż+H2O£¬¹ŹB²»Ń”£»C£®ĻņNaHSO4ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮ¹żĮ棬Ąė×Ó·“Ó¦ĪŖBa2++OH©+SO42©+H+ØTBaSO4”ż+H2O£¬¹ŹC²»Ń”£»¹Ź“š°øĪŖ£ŗA£»£Ø3£©¼ÓČėĻ”ĮņĖįÖ±ÖĮ¹żĮ棬Ē”ŗĆ·“Ó¦Ź±µ¼µēŠŌĪŖ0£¬¹żĮæŗóĄė×ÓÅضČŌö“󣬵¼µēŠŌŌöĒ棬Ķ¼ÖŠÖ»ÓŠC·ūŗĻ£¬¹Ź“š°øĪŖ£ŗC£» £Ø4£©ĻņøĆÉÕ±Ąļ»ŗ»ŗ×¢ČėÓėBa£ØOH£©2ČÜŅŗµČĆܶȵÄĻ”ĮņĖįÖĮĒ”ŗĆĶźČ«·“Ó¦£¬Éś³ÉĮņĖį±µŗĶĖ®£¬ČÜŅŗµÄĆܶȊ”ÓŚBa£ØOH£©2ČÜŅŗµÄĆÜ¶Č£¬ĖÜĮĻŠ”Ēņ½«³Įµ½ÉÕ±µ×²æ£¬
¹Ź“š°øĪŖ£ŗ³Įµ½ÉÕ±µ×²æ£®
£Ø1£©·“Ӧɜ³ÉĮņĖį±µŗĶĖ®£¬ĮņĖį±µŗĶĖ®ŌŚĄė×Ó·“Ó¦ÖŠ¾ł±£Įō»ÆѧŹ½£»£Ø2£©Ē”ŗĆĶźČ«·“Ó¦Ź±£¬ČÜŅŗĪŖÖŠŠŌ£»£Ø3£©¼ÓČėĻ”ĮņĖįÖ±ÖĮ¹żĮ棬Ē”ŗĆ·“Ó¦Ź±µ¼µēŠŌĪŖ0£¬¹żĮæŗóĄė×ÓÅضČŌö“󣬵¼µēŠŌŌöĒ棻£Ø4£©ĻņøĆÉÕ±Ąļ»ŗ»ŗ×¢ČėÓėBa£ØOH£©2ČÜŅŗµČĆܶȵÄĻ”ĮņĖįÖĮĒ”ŗĆĶźČ«·“Ó¦£¬Éś³ÉĮņĖį±µŗĶĖ®£¬ČÜŅŗµÄĆܶȊ”ÓŚBa£ØOH£©2ČÜŅŗµÄĆÜ¶Č£¬ŅŌ“ĖĄ“½ā“š£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫µķ·Ū½¬ŗĶµķ·ŪĆøµÄ»ģŗĻĪļ·ÅČė°ėĶøĤ“üÖŠ£¬ŌśŗĆŗó½žČėĮ÷¶ÆµÄĪĀĖ®ÖŠ£¬¾¹ż×ć¹»³¤µÄŹ±¼ä£¬Č”³ö“üÄŚµÄŅŗĢ壬·Ö±šÓė¢ŁµāĖ®””¢ŚŠĀÖĘCu(OH)2¼ÓČČ””¢ŪÅØĻõĖį(Ī¢ČČ)×÷ÓĆ£¬ĘäĻÖĻóŅĄ“ĪŹĒ
A. ĻŌĄ¶É«£»ĪŽ×©ŗģÉ«³Įµķ£»ĻŌ»ĘÉ« B. ²»ĻŌĄ¶É«£»ĪŽ×©ŗģÉ«³Įµķ£»ĻŌ»ĘÉ«
C. ĻŌĄ¶É«£»ÓŠ×©ŗģÉ«³Įµķ£»²»ĻŌ»ĘÉ« D. ²»ĻŌĄ¶É«£»ÓŠ×©ŗģÉ«³Įµķ£»²»ĻŌ»ĘÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æīęŹĒµŲæĒÖŠŗ¬Įæ×īøßµÄĻ”ĶĮŌŖĖŲ£¬¶žŃõ»Æīę(CeO2)ŹĒĘäÖŲŅŖµÄ»ÆŗĻĪļ”£Ę½°åŅŗ¾§ĻŌŹ¾ĘĮÉś²ś¹ż³ĢÖŠ²śÉś“óĮæµÄ·Ļ²£Į§·ŪÄ©£¬ĘäÖŠŗ¬CeO2”¢SiO2”¢Fe2O3µČĪļÖŹ£¬Ä³ŹµŃ銔×éŅŌ“Ė·ŪÄ©ĪŖŌĮĻ»ŲŹÕīę£¬Éč¼ĘĮ÷³ĢČēĶ¼ĖłŹ¾£ŗ
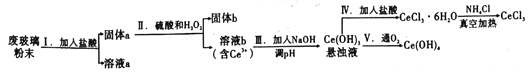
£Ø1£©²½Öč¢ń¼ÓČė¹żĮæŃĪĖįŗó£¬ČÜŅŗaÖŠµÄŃōÓŠĄė×Ó___________________”£
£Ø2£©²½Öč¢ņÖŠ·“Ó¦µÄŃõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®ĪŖ___________”£
£Ø3£©ĪŖĮĖŹ¹²½Öč¢óĖłµĆŠü×ĒŅŗÖŠµÄCe3+ÅضČĪŖ1”Į10-6mol”¤L-1£¬Ōņ¼ÓČėNaOHµ÷½ŚČÜŅŗµÄpHÓ¦ĪŖ____________[ŅŃÖŖ£ŗCe(OH)3µÄKsp=8.0”Į10-21£¬lg2=0.3]”£
£Ø4£©½«NH4Cl¹ĢĢåÓėCeCl3”¤6H2O»ģŗĻÕęæÕ¼ÓČČæɵĆĪŽĖ®CeCl3£¬ĘäÖŠ¼ÓČėNH4ClµÄ×÷ÓĆŹĒ__________”£
£Ø5£©µŚ¢õ²½·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ____________________£»ÓĆ·“Ó¦µĆµ½µÄŠü×ĒŅŗÖʱø“æ¾»µÄCe(OH)4Šč½ųŠŠµÄŹµŃé²Ł×÷ĪŖ______________”£
£Ø6£©¶ŌCeCl3ѳʷ“æ¶Č½ųŠŠ²ā¶ØµÄ·½·Ø£ŗ×¼Č·³ĘȔѳʷwgÅä³É100mLČÜŅŗ£¬Č”25.00mLÖĆӌ׶ŠĪĘæÖŠ£¬¼ÓČėÉŌ¹żĮæµÄ¹ż¶žĮņĖįļ§[(NH4)2S2O8]ČÜŅŗ½«Ce3+Ńõ»ÆĪŖCe4+£¬Č»ŗóÓĆŻĶČ”¼Į[ÓĆ(HT2)±ķŹ¾]ŻĶČ”Ce4+£¬ŌŁÓĆcmol”¤L-1(NH4)2Fe(SO4)2±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć(ĘäĄė×Ó·“Ó¦·½³ĢŹ½ĪŖCe4++Fe2+=Ce3++Fe3+)£¬ÖŲø“2”«3“Ī£¬Ę½¾łĻūŗÄVmL±ź×¼ČÜŅŗ”£
¢Ł”°ŻĶČ””±Ź±“ęŌŚ·“Ó¦£ŗCe4++n(HT)2![]() Ce(H2n-4)+4H+£¬ČōŅŖĢįøßµĪ¶ØµÄ×¼Č·ĀŹ£¬Ó¦Ź¹ČÜŅŗ³Ź______ŠŌ(Ģī”°Ėį”±”°ÖŠ”±»ņ”°¼ī”±)”£
Ce(H2n-4)+4H+£¬ČōŅŖĢįøßµĪ¶ØµÄ×¼Č·ĀŹ£¬Ó¦Ź¹ČÜŅŗ³Ź______ŠŌ(Ģī”°Ėį”±”°ÖŠ”±»ņ”°¼ī”±)”£
¢Ś¾¼ĘĖć£¬CeCl3ѳʷµÄ“æ¶ČĪŖ________________”£ [M(CeCl3)=246.5g”¤mol-1]
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æI.X”¢Y”¢Z”¢WŹĒ֊ѧ»Æѧ֊³£¼ūµÄĖÄÖÖĘųĢ唣¼ŗÖŖ£ŗX”¢Y”¢ZČżÖÖĘųĢ嶼ÄܶŌ“óĘųŌģ³ÉĪŪČ¾£¬ŌŚ¹¤ŅµÉĻ¶¼æÉŅŌÓĆ¼īŅŗĪüŹÕ£»XŹĒ»ÆŹÆČ»ĮĻČ¼ÉյIJśĪļÖ®Ņ»£¬ŹĒŠĪ³ÉĖįÓźµÄĪļÖŹ£»YŹĒŅ»ÖÖµ„ÖŹ£¬ĖüµÄĖ®ČÜŅŗĘäÓŠĘÆ°××÷ÓĆ£»ZŹĒĻõĖį¹¤ŅµŗĶĘū³µĪ²ĘųÖŠµÄÓŠŗ¦ĪļÖŹÖ®Ņ»£¬ÄÜÓėĖ®·“Ó¦£»WĘųĢåµÄĖ®ČÜŅŗµĪČė·ÓĢŖ±äŗģÉ«”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©X”¢YĮ½ÖÖĘųĢå°“ĪļÖŹµÄĮæÖ®±Č1:1ŌŚĖ®ČÜŅŗÖŠÄÜ·¢Éś·“Ó¦£¬»Æѧ·½³ĢŹ½ĪŖ_______£»
£Ø2£©æĘѧ¼Ņ·¢ĻÖ£¬ZŌŚ“߻ƼĮĢõ¼žĻĀÄÜÓėW·“Ó¦£¬·“Ó¦²śĪļÖŠÓŠµ„ÖŹÉś³É£¬øƵ„ÖŹÓ¦ŹĒ£ØĢī»ÆѧŹ½£©____________£»øĆ·“Ó¦ŹĒŃõ»Æ»¹Ō·“Ó¦£¬ŌņĘäÖŠµÄŃõ»Æ¼ĮŹĒ£ØĢī»ÆѧŹ½£©_______”£
£Ø3£©ŌŚZÓėĖ®µÄ·“Ó¦ÖŠ£¬Ńõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ________”£
£Ø4£©¼ģŃéWĘųĢåµÄ·½·ØŹĒ_____________”£
II.H2SŗĶSO2»į¶Ō»·¾³ŗĶČĖĢ彔浓ųĄ“¼«“óµÄĪ£ŗ¦£¬¹¤ŅµÉĻ²ÉČ”¶ąÖÖ·½·Ø¼õÉŁÕāŠ©ÓŠŗ¦ĘųĢåµÄÅÅ·Å£¬ĘäÖŠÉśĪļĶŃH2SµÄŌĄķĪŖ£ŗ
H2S+Fe2(SO4)3=S+2FeSO4+H2SO4
4FeSO4+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
»Ų“šĻĀĮŠ·½·ØÖŠµÄĪŹĢā”£
£Øl£©ĮņøĖ¾ś“ęŌŚŹ±£¬FeSO4±»Ńõ»ÆµÄĖŁĀŹŹĒĪŽ¾śŹ±µÄ5”Į105±¶£¬øĆ¾śµÄ×÷ÓĆŹĒ_______”£
£Ø2£©ÓÉĶ¼1ŗĶĶ¼2ÅŠ¶ĻŹ¹ÓĆĮņøĖ¾śµÄ×ī¼ŃĢõ¼žĪŖ______”£Čō·“Ó¦ĪĀ¶Č¹żøߣ¬·“Ó¦ĖŁĀŹĻĀ½µ£¬ĘäŌŅņŹĒ______________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°Ē§“øĶņŌä³öÉīɽ£¬ĮŅ»š·ŁÉÕČōµČĻŠ”£·ŪÉķĖé¹Ē»ė²»ÅĀ£¬Ö»ĮōĒå°×ŌŚČĖ¼ä”£”±Ć÷“śŹ«ČĖÓŚĒ«µÄ”¶ŹÆ»ŅŅ÷”·ÖŠ¶Ō”°CaCO3”śCaO”±µÄ×Ŗ»Æ½ųŠŠÄāČĖ»ÆĆčŹö”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ÉĻŹö×Ŗ»ÆŹōÓŚ·Ö½ā·“Ó¦ B. ÉĻŹö×Ŗ»Æ¹ż³Ģ·Å³ö“óĮæČČ
C. Éś³ÉµÄCaOæÉ×÷ĀČĘųµÄøÉŌļ¼Į D. CaCO3ŹĒĖ®ÄąµÄÖ÷ŅŖ³É·ÖÖ®Ņ»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷ĢžÖŠ£¬ĶźČ«Č¼ÉÕŹ±Éś³ÉCO2ÓėH2OµÄĪļÖŹµÄĮæÖ®±ČĪŖ1 £ŗ1µÄŹĒ£Ø £©
A.C2H6 B.C2H4 C.C2H2 D.C6H6
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµ£¬ŌņĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
A.±ź×¼×“æöĻĀ£¬a LµÄŃõĘųŗĶµŖĘųµÄ»ģŗĻĪļŗ¬ÓŠµÄ·Ö×ÓŹżŌ¼ĪŖ ![]() ”Į6.02”Į1023
”Į6.02”Į1023
B.ÓÉ1L 1 mol?L©1µÄ FeCl3ČÜŅŗÖĘ³ÉµÄ½ŗĢåÖŠ½ŗĮ£×ÜŹżŠ”ÓŚNAøö
C.2.3g½šŹōÄʱäĪŖÄĘĄė×ÓŹ§Č„0.1NAµē×Ó
D.2.24L CO2ÖŠŗ¬ÓŠµÄŌ×ÓŹżĪŖ3”Į0.1”Į6.02”Į1023
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫4gNaOH¹ĢĢåČÜÓŚĖ®Åä³É250mLČÜŅŗ£¬“ĖČÜŅŗÖŠNaOHµÄĪļÖŹµÄĮæÅضČĪŖmol/L£®Č”³ö10mL“ĖČÜŅŗ£¬ĘäÖŠŗ¬ÓŠNaOHg£®½«Č”³öµÄČÜŅŗ¼ÓĖ®Ļ”ŹĶµ½100mL£¬Ļ”ŹĶŗóČÜŅŗÖŠNaOHµÄĪļÖŹµÄĮæÅضČĪŖmol/L£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠĻĀĮŠ¼øÖÖ·½·ØÖʱøO2£ŗ£Ø1£©KClO3ŗĶMnO2¹²ČČ£¬£Ø2£©H2O2ÖŠ¼ÓMnO2 £¬ £Ø3£©KMnO4ŹÜČČ·Ö½ā£¬ČōŅŖÖĘĻąĶ¬ÖŹĮæµÄO2 £¬ ŌņÉĻŹö·“Ó¦ÖŠĻą¹ŲĪļÖŹ×ŖŅʵĵē×ÓŹżÖ®±ČĪŖ£Ø £©
A.3£ŗ2£ŗ4
B.1£ŗ1£ŗ1
C.2£ŗ1£ŗ2
D.1£ŗ2£ŗ1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com