
【题目】[化学―有机化学基础]
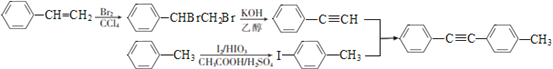
化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
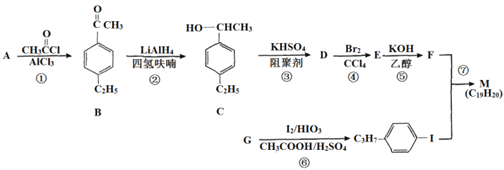
回答下列问题:
⑴G的结构简式为_____________________
⑵C中含有的官能团名称是________
⑶反应②的反应类型是_________,反应⑥的反应类型是______
⑷反应⑤的化学方程式为________________________
⑸能同时满足下列条件的B的同分异构体有____种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:l:l的是_________(写结构简式)。
①苯环上有两个取代基 ②能发生银镜反应
⑹参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线_________。
的合成路线_________。
【答案】 ![]() 羟基 还原反应 取代反应
羟基 还原反应 取代反应 ![]() +2KOH
+2KOH![]()
![]() +2KBr+2H2O 15
+2KBr+2H2O 15 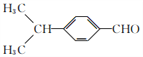
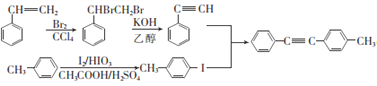
【解析】试题分析:本题考查有机推断和有机合成,有机物结构简式和有机方程式的书写,官能团的识别,有机反应类型的判断,限定条件同分异构体数目的确定和书写,有机合成路线的设计。A是单取代芳香烃,根据反应①和B的结构简式可逆推出A的结构简式为![]() ;A、G互为同系物,G是单取代芳香烃,根据反应⑥及其生成物的结构简式可逆推出G的结构简式为
;A、G互为同系物,G是单取代芳香烃,根据反应⑥及其生成物的结构简式可逆推出G的结构简式为![]() ;C发生反应③生成D,D与Br2/CCl4发生加成反应生成E,E与KOH/乙醇作用发生消去反应生成F,结合C的结构简式,D的结构简式为
;C发生反应③生成D,D与Br2/CCl4发生加成反应生成E,E与KOH/乙醇作用发生消去反应生成F,结合C的结构简式,D的结构简式为![]() ,E的结构简式为
,E的结构简式为![]() ,F的结构简式为
,F的结构简式为![]() 。化合物M是二苯乙炔类液晶材料的一种,结合M的分子式C19H20,反应⑦为取代反应,M的结构简式为
。化合物M是二苯乙炔类液晶材料的一种,结合M的分子式C19H20,反应⑦为取代反应,M的结构简式为![]() 。
。
(1)G的结构简式为![]() 。
。
(2)根据C的结构简式知,C中含有的官能团的名称是羟基。
(3)对比B和C的结构简式,B→C为羰基还原为羟基,反应②为还原反应。反应⑥为G中—C3H7对位的苯环氢原子被I取代,反应⑥为取代反应。
(4)反应⑤为E发生消去反应生成F,化学方程式为![]() +2KOH
+2KOH![]()
![]() +2KBr+2H2O。
+2KBr+2H2O。
(5)B的同分异构体能发生银镜反应,B的同分异构体中含醛基,B的同分异构体的苯环上有两个取代基,两个取代基可以为:①—CHO和—CH2CH2CH3,②—CHO和—CH(CH3)2,③—CH2CHO和—CH2CH3,④—CH2CH2CHO和—CH3,⑤![]() 和—CH3,当苯环上有两个取代基时,两个取代基有邻、间、对三种位置,则满足条件的B的同分异构体有5
和—CH3,当苯环上有两个取代基时,两个取代基有邻、间、对三种位置,则满足条件的B的同分异构体有5![]() 3=15种。其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式为
3=15种。其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式为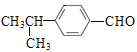 。
。
(6)对比![]() 、
、![]() 和
和![]() 结构简式,联想流程中反应⑦,由
结构简式,联想流程中反应⑦,由![]() 合成
合成![]() ,由
,由![]() 合成
合成![]() ;
;![]() 合成
合成![]() 模仿流程中反应④、反应⑤,
模仿流程中反应④、反应⑤,![]() 合成
合成![]() 模仿流程中反应⑥;合成路线的流程图为:
模仿流程中反应⑥;合成路线的流程图为:
 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 丙烯的电子式为: ![]()
B. 二乙酸乙二酯的结构简式为: ![]()
C. 苯酚钠溶液中通入少量CO2的离子方程式为:![]() +H2O+CO2
+H2O+CO2![]()
![]() +HCO3—
+HCO3—
D. 甲醛与足量的银氨溶液反应的化学方程式为:HCHO+2Ag(NH3)2OH ![]() HCOONH4+2Ag↓+3NH3+H2O
HCOONH4+2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7是一种强氧化剂)的主要工艺流程如下:
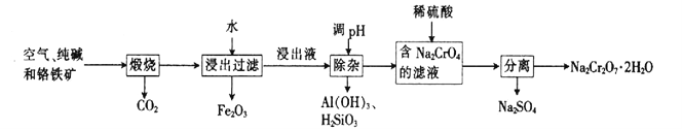
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
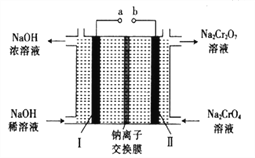
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4转化为1malNa2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式或离子共存的叙述正确的是
A. 将磁性氧化铁溶于氢碘酸: Fe3O4+ 8H+= 2Fe3++ Fe2+ + 4H2O
B. 用肥皂(主要成份C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO-+Ca2+=(C17H35COO)2Ca↓
C. 常温下,在![]() =0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
=0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
D. 在NaClO溶液中:SO32-、OH-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
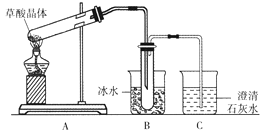
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Ca是六种重要的元素请根据所学的物质结构与性质的4机关知识下列问题:
(1)基态碳原子的电子排布式为__,O和F形成的化合物中原子价层都满足8电子结构的结构式是__,O元素的化合价为________.
(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于__(填“吸收”或“发射”)光谱。
(3)某药物的结构简式为![]() ,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
(4)CO2属于_____(填“极性”或”非极性”)分子。CO32-的空间构型为_____,与其互为等电子体的分子和离子分别为_________(各写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物C为中学常见的化合物。
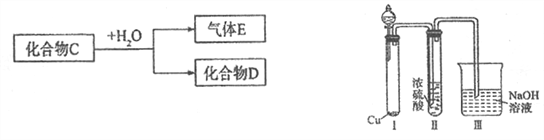
(1)若D是一种强酸,则C与水反应的化学方程式为__________________________。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入_______________,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是__________________。
(2)若D是一种常见的强碱,则C的电子式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)上图四个装置常用于实验室制取气体,其中制取氯气选用的装置为_______________,反应的离子方程式为______________________。
(2)从下图装置左端分别通入氯气或二氧化硫时,装置B中观察到的现象是否相同________(填“相同”或“不相同”);装置A反应后溶液均褪色,如何利用褪色后的溶液判断是何种气体使其褪色______________(写出简要的实验步骤);

(3)装置F中盛放的溶液为______________(填溶质的化学式);若装置E中试剂为铁丝,则通入氯气与铁丝充分反应的化学方程式为______________;
(4)当通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象。该反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com