
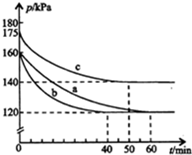
 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )| A. | Q<0 | |
| B. | 与实验a相比,实验b加入了催化剂 | |
| C. | 实验b条件下,该反应的平衡常数K=2 | |
| D. | 实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=4.0×10-3mol/(L•min) |
分析 A.a、c比较,体积、物质的量相同,c中压强大,则c中温度高,由反应前后的压强比判断反应进行的程度;
B.与实验a相比,b实验到达平衡的时间变小,但平衡没有发生移动;
C.实验b,起始时AX3和X2均为1mol,即no=2mol,总压强为160KPa,平衡时总压强为120KPa,根据压强之比等于物质的量之比,平衡时总物质的量为n=1.5mol,
AX3(g)+X2(g)?AX5(g)
初始 1 1 0
变化 x x x
平衡 1-x 1-x x
(1-x)+(1-x)+x=1.5,解得x=0.5
则K=$\frac{\frac{0.5mol}{2L}}{\frac{0.5mol}{2L}×\frac{0.5mol}{2L}}$;
D.实验c,起始时AX3和X2均为1mol,即no=2mol,总压强为175KPa,平衡时总压强为140KPa,根据压强之比等于物质的量之比,平衡时总物质的量为n=2mol×$\frac{140}{175}$=1.6mol,
AX3(g)+X2(g)?AX5(g)
初始 1 1 0
变化 x x x
平衡 1-x 1-x x
(1-x)+(1-x)+x=1.6,解得x=0.4,
结合v=$\frac{△c}{△t}$计算.
解答 解:A.a、c比较,体积、物质的量相同,c中压强大,则c中温度高,由$\frac{140}{175}$>$\frac{120}{160}$,可知C中温度高反应物的转化率小,则正反应为放热反应,Q<0,故A正确;
B.与实验a相比,b实验到达平衡的时间变小,但平衡没有发生移动,则与实验a相比,实验b加入了催化剂,故B正确;
C.实验b,起始时AX3和X2均为1mol,即no=2mol,总压强为160KPa,平衡时总压强为120KPa,根据压强之比等于物质的量之比,平衡时总物质的量为n=1.5mol,
AX3(g)+X2(g)?AX5(g)
初始 1 1 0
变化 x x x
平衡 1-x 1-x x
(1-x)+(1-x)+x=1.5,解得x=0.5
则K=$\frac{\frac{0.5mol}{2L}}{\frac{0.5mol}{2L}×\frac{0.5mol}{2L}}$=4,故C错误;
D.实验c,起始时AX3和X2均为1mol,即no=2mol,总压强为175KPa,平衡时总压强为140KPa,根据压强之比等于物质的量之比,平衡时总物质的量为n=2mol×$\frac{140}{175}$=1.6mol,
AX3(g)+X2(g)?AX5(g)
初始 1 1 0
变化 x x x
平衡 1-x 1-x x
(1-x)+(1-x)+x=1.6,解得x=0.4,
实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=$\frac{\frac{0.4mol}{2L}}{50min}$=4.0×10-3mol/(L•min),故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K和速率的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的难点,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t 1 | t 2 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
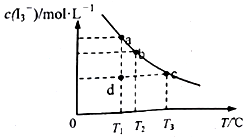 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )| A. | 温度为T1时,向该平衡体系中加入KI固体,平衡正向移动 | |
| B. | 反应I2(aq)+I-(aq)═I3-(aq)△H<0 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪经) | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
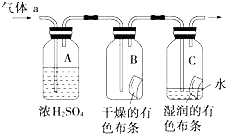 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com