
| A、40% | B、34% |
| C、28.6% | D、25.4% |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、从平衡常数的大小可以推断任意反应进行的程度 |
| B、K值越大,反应的转化率越小 |
| C、K值越大,反应的转化率越大 |
| D、温度越高,K值越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g钠由原子变成离子时,失去的电子数为NA |
| B、0.2 NA个H2SO4分子与19.6gH3PO4含有相同的氧原子数 |
| C、28g氮气所含的原子数为NA |
| D、NA个氧分子与NA个氢分子的质量比为8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2的电子式: | ||
| B、106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况) | ||
C、邻羟基苯甲酸的结构简式: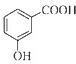 | ||
D、质子数为53,中子数为78的碘原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO2)?c(NO) |
| c(NO2)?c(CO) |
| A、该反应的化学方程式为:NO2+CO═CO2+NO |
| B、该反应的焓变为负值 |
| C、升高温度,正反应速率减小 |
| D、恒温时,增大压强,颜色加深,因平衡左移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | ||||
| B、向硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- | ||||
C、用石墨作电极电解熔融氯化镁:2Cl-+2H2O
| ||||
| D、向硝酸亚铁溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com