
| A. | O2-1s22s22p4 | B. | Ca 3d2 | ||
| C. | Fe 3d54s3 | D. | Si 1s22s22p63s23p2 |
分析 电子排布遵循能量最低原理、泡利原理,按照1s、2s、2p、3s、3p、4s、3d…的顺序填充电子,以此来解答.
解答 解:A.O的质子数为8,得到2个电子变为离子,则O2-的电子排布式为1s22s22p6,故A错误;
B.Ca原子核外电子排布式为[Ar]4s2或1s22s22p63s23p64s2,故B错误;
C.Fe原子核外电子排布式为[Ar]3d64s2,4s最多有2个电子,故C错误;
D.Si的质子数为14,则Si的电子排布式为1s22s22p63s23p2,故D正确;
故选D.
点评 本题考查原子核外电子排布,为高频考点,把握电子排布规律、能量最低原理为解答的关键,侧重分析与应用能力的考查,注意电子层上最多容纳的电子数,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
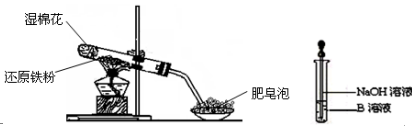
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 停止冬季供暖,减少有害物质排放 | |
| B. | 对锅炉和汽车等产生的有害气体和烟尘进行处理 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 寻找新能源,减少化石燃料的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
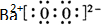 (写电子式).
(写电子式).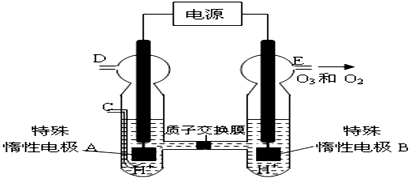
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
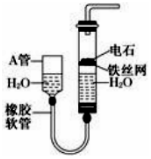 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去CO2中混有的CO:通入O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去SO2中混有的HCl,可将气体通入足量的饱和NaHSO3溶液 | |
| D. | 除去粗盐中的MgCl2、CaCl2和Na2SO4,可加入药品顺序:NaOH→Na2CO3→BaCl2→盐酸. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:
太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11CI的有机物,分子结构中含2个甲基的同分异构体有4种 | |
| B. | CH3COOH与C2H518OH在浓硫酸作用下加热,反应生有机物分子的结构简式为CH3COOC2H5 | |
| C. | 三氯甲烷只有一种结构,不存在同分异构,证明甲烷是正四面体构型 | |
| D. | 煎炸食物的花生油和牛油都是可皂化的饱和醋类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com