
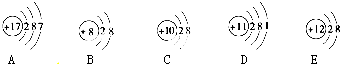


科目:高中化学 来源: 题型:
 下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:
下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:查看答案和解析>>
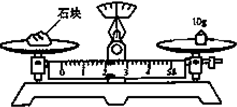
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量盐酸 |
| 足量盐酸 |
| 足量盐酸 |
| 过量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 用 品 | 溶 液 温 度 | △t | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
| ③ | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 25.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电镀的酸性废液用碱中和后还是不可以排放 |
| B、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| C、碘是人体必需微量元素,所以要多吃富含KIO3的食盐 |
| D、室温下,AgCl在水中的溶解度小于在食盐中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com