
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| B、pH=5的①NH4Cl溶液②CH3COOH溶液③稀盐酸溶液中c(H+)水:①>②>③ |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D、0.1 mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则b<a+l |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
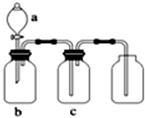 如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | 二氧化氮 | 浓硝酸 | 铜片 | 氢氧化钠溶液 |
| B | 二氧化硫 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | 氨 | 浓氨水 | 生石灰 | 碱石灰 |
| D | 二氧化碳 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B、Mg(OH)2的溶度积小于MgCO3的溶度积,且在水中发生了沉淀转化 |
| C、MgCO3电离出的CO32-发生水解,使水中OH-浓度减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp生成Mg(OH)2沉淀 |
| D、MgCO3电离出的CO32-发生水解,使水中OH-浓度增大,对Mg (OH)2的沉淀溶解平衡而言,Qc>Ksp生成Mg(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.物质T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的N2和CO所含分子数均为NA |
| B、2.54g C18H38中含有的共价键数为0.55NA |
| C、1molNa2O2 固体中含离子总数为4 NA |
| D、标准状况下,2.24L戊烷所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com