
| A. | 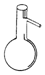 蒸馏烧瓶 | B. |  分液漏斗 | C. | 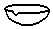 蒸发皿 | D. | 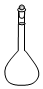 溶量瓶 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Cu2+、K+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、HCO3-、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Na+、K+、Cl?、SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中氧化产物和还原产物的物质的量之比是1:2 | |
| C. | 反应中每生成5.7gAlON同时生成1.12LCO | |
| D. | AlON和CO的化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 尿毒症患者使用血液透析治疗 | |
| C. | 明矾净水 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08 | B. | 0.04 | C. | 0.032 | D. | 0.036 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
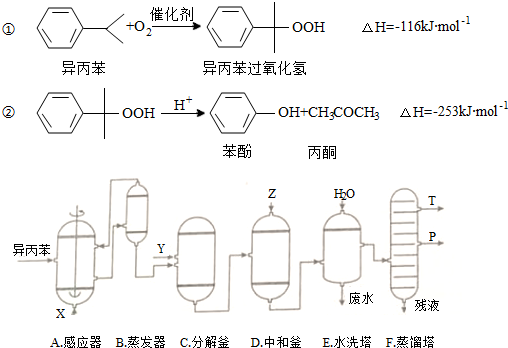
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com