
【题目】已知SiO2+2C![]() Si+2CO↑;Si+C
Si+2CO↑;Si+C![]() SiC。
SiC。
现有石英砂和炭粉的混合物1mol,于高温下在电炉里充分反应后,得残留固体;若石英砂与混和物的物质的量之比n(0<n<1),试讨论n取何值时,残留物的成分及其物质的量。
n | 例︰n= | __ | __ | __ | __ |
残留固体及物质的量(摩) | Si | __ | __ | __ | __ |
___________。
【答案】
n值 | n= | n= |
|
| 0<n< |
残留固体及 物质的量 | Si
| SiC
| Si SiO2 | Si(4n-1)mol SiC(1-3n)mol | SiC nmol C(1-4n)mol |
【解析】
根据反应SiO2+2C![]() Si+2CO↑,Si+C
Si+2CO↑,Si+C![]() SiC可得:SiO2+3C
SiC可得:SiO2+3C![]() SiC+2CO↑;
SiC+2CO↑;
①当n=![]() 时,二氧化硅与C恰好反应生成一氧化碳和单质硅,残留的固体为Si,其物质的量为
时,二氧化硅与C恰好反应生成一氧化碳和单质硅,残留的固体为Si,其物质的量为![]() mol;
mol;
②当n=![]() 时,二氧化硅与C恰好反应生成SiC,残留的固体为SiC,物质的量为
时,二氧化硅与C恰好反应生成SiC,残留的固体为SiC,物质的量为![]() mol;
mol;
③当![]() <n<1时,二氧化硅过量,反应后的固体为SiO2和Si的混合物,根据反应SiO2+2C
<n<1时,二氧化硅过量,反应后的固体为SiO2和Si的混合物,根据反应SiO2+2C![]() Si+2CO↑,C完全反应,则生成Si的物质的量为:n(Si)=
Si+2CO↑,C完全反应,则生成Si的物质的量为:n(Si)=![]() n(C)=
n(C)=![]() ×(1-n)mol=
×(1-n)mol=![]() mol,剩余的二氧化硅为:n-
mol,剩余的二氧化硅为:n-![]() mol=
mol=![]() mol;
mol;
④当![]() <n<
<n<![]() 时,二氧化硅与碳完全反应生成Si和SiC,设生成Si为ymol,则生成SiC为:nmol-ymol,根据C的物质的量关系可得:2ymol+3(nmol-ymol)=(1-n)mol,解得:y=(4n-1)mol,即Si的物质的量为(4n-1)mol,则SiC的物质的量为:nmol-(4n-1)mol=(1-3n)mol;
时,二氧化硅与碳完全反应生成Si和SiC,设生成Si为ymol,则生成SiC为:nmol-ymol,根据C的物质的量关系可得:2ymol+3(nmol-ymol)=(1-n)mol,解得:y=(4n-1)mol,即Si的物质的量为(4n-1)mol,则SiC的物质的量为:nmol-(4n-1)mol=(1-3n)mol;
⑤当0<n<![]() 时,则反应后C有剩余,残留固体为SiC和C,二氧化硅完全反应,则残留固体中含有SiC的物质的量为:nmol,根据反应SiO2+3C
时,则反应后C有剩余,残留固体为SiC和C,二氧化硅完全反应,则残留固体中含有SiC的物质的量为:nmol,根据反应SiO2+3C![]() SiC+2CO↑,剩余C的物质的量为:(1-n)mol-3nmol=(1-4n)mol,故答案为:
SiC+2CO↑,剩余C的物质的量为:(1-n)mol-3nmol=(1-4n)mol,故答案为:
n值 | n= | n= |
|
| 0<n< |
残留固体及 物质的量 | Si
| SiC
| Si SiO2 | Si(4n-1)mol SiC(1-3n)mol | SiC nmol C(1-4n)mol |


科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3达到平衡状态
2NH3达到平衡状态
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]() 含
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() ,下列分析错误的是
,下列分析错误的是![]()
![]()

A.干燥管b中装入碱石灰
B.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
C.测定总体积后,关闭![]() ,打开
,打开![]() ,可观察到Q气球慢慢缩小,并测出氧气体积
,可观察到Q气球慢慢缩小,并测出氧气体积
D.Q气球中产生的气体主要成份![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是( )
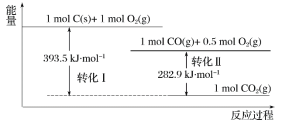
A.1molC(g)与1molO2(g)的能量之和为393.5kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量
C.由C→CO的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2kJ·mol-1
D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合H+能力的相对强弱:H2O_____NH3(填“>”、“<”或“=”);用一个离子方程式说明H3O+和NH4+给出H+能力的相对强弱_____。
(2)NaCN是离子化合物,各原子均满足8电子稳定结构。写出NaCN的电子式_____。
(3)乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为120g·mol-1,从结构上分析其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平的两个托盘上各放一只相同的烧杯,再分别向两烧杯中放入等质量、等质量分数且足量的稀硫酸,调节天平至平衡。然后,向一只烧杯中加入一定质量的镁,向另一烧杯中加入等质量的铜、铝合金,反应后天平仍然保持平衡。则该合金中铜与铝的质量比为( )
A. 64∶27B. 8∶3C. 3∶1D. 1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有三个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是 |
![]() 用化学用语回答下列问题:
用化学用语回答下列问题:
![]() 元素在周期表中的位置 ______ ;
元素在周期表中的位置 ______ ;![]() 单质分子的电子式 ______ ;
单质分子的电子式 ______ ;
![]() 的原子结构示意图 ______ ;
的原子结构示意图 ______ ;![]() 电子式表示A和B元素组成的化合物的形成过程: ______ .
电子式表示A和B元素组成的化合物的形成过程: ______ .
![]() 元素D与元素A相比,非金属性较强的是 ______
元素D与元素A相比,非金属性较强的是 ______ ![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是 ______
,下列表述中能证明这一事实的是 ______ ![]() 填选项序号
填选项序号![]() .
.
![]() 常温下D的单质和A的单质状态不同
常温下D的单质和A的单质状态不同
![]() 的氢化物比A的氢化物稳定
的氢化物比A的氢化物稳定
![]() 一定条件下D和A的单质都能与钠反应
一定条件下D和A的单质都能与钠反应
![]() 最高价含氧酸的酸性弱于D最高价含氧酸
最高价含氧酸的酸性弱于D最高价含氧酸
![]() 单质能与A的氢化物反应生成A单质
单质能与A的氢化物反应生成A单质
![]() 是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为
是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为![]() 其他条件略去
其他条件略去![]() .
.
![]()
![]() 若Y是有刺激性气味的无色气体,把Y通入
若Y是有刺激性气味的无色气体,把Y通入![]() 溶液中,无现象,然后滴加适量
溶液中,无现象,然后滴加适量![]() 溶液,有白色沉淀生成,则该白色沉淀为 ______ ,试写出Y与
溶液,有白色沉淀生成,则该白色沉淀为 ______ ,试写出Y与![]() 溶液反应的化学方程式: ______ ;
溶液反应的化学方程式: ______ ;
![]() 若Z是红棕色气体,则
若Z是红棕色气体,则![]() 的反应中氧化剂与还原剂物质的量之比为 ______ .
的反应中氧化剂与还原剂物质的量之比为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com