

| (C1V1-C2V2)×10-3mol×17g/mol |
| wg |
| (C1V1-C2V2)×10-3mol×17g/mol |
| wg |
| Ksp |
| c2(Ag+) |
| 1.12×10-12 |
| (2.0×10-5)2 |
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 醇 |
| Br2,P |
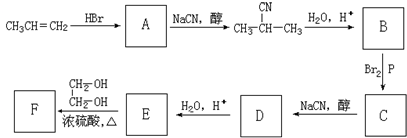
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、③②① |
| C、②①③ | D、②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:
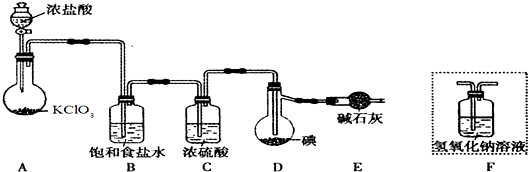
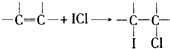
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙烷(乙烯) | 氢气 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
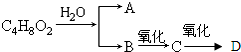
查看答案和解析>>
科目:高中化学 来源: 题型:
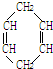 可简写为
可简写为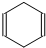 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 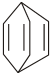 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下NaB溶液的pH=8,c(Na+)-c(B-)=1×10-2 mol/L |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、KHSO3溶液呈酸性,c(K+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
| D、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O等体积混合后溶液呈碱性:c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com