
【题目】常温下,改变0.1 molL-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知]
(X)随pH的变化如图所示[已知]![]() (X)=
(X)=![]() 。下列叙述错误的是( )
。下列叙述错误的是( )

A.pH=1.2时, c(K+)+c(H+)=c(H2A) + c(OH-)+2c(A2-)
B.常温下,H2A的电离平衡常数Ka2 =10-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.KHA溶液中粒子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
【答案】D
【解析】
由图象可知,pH=1.2时,c(H2A)=c(HA-),pH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题。
A、由图象可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),溶液中存在电荷守恒得到,c(K+)+c(H+)=2c(A2-)+c(HA-)+c(OH-)=2c(A2-)+c(H2A)+c(OH-),故A正确;
B、pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),Ka2= =10-4.2,,故B正确;
=10-4.2,,故B正确;
C、由图象可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知:c(HA-)> c(H2A)=c(A2-),故C正确;
D、H2A的Ka1= =10-1.2,故A2-的Kh2=
=10-1.2,故A2-的Kh2=![]() =10-12.8,HA-的电离常数大于其水解常数,KHA溶液pH小于7,溶液显酸性,溶液中离子浓度为:c(K+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A),故D错误;
=10-12.8,HA-的电离常数大于其水解常数,KHA溶液pH小于7,溶液显酸性,溶液中离子浓度为:c(K+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A),故D错误;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:
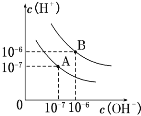
①则25℃时水的电离平衡曲线应为_____。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____。
(3)下列说法中正确的是_____。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态 K 原子中,核外电子占据的最高能层的符号是_____,占据该能层电子的电子云轮廓图形状为_____。K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔 点、沸点等都比金属 Cr 低,原因是_____。
(2)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为____________,中心原子的杂化类型为_______________ 。
(3)KIO3 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结 构,边长为 a=0.446nm,晶胞中 K、I、O 分别处于顶角、体心、面心位置, 如图所示。K 与 O 间的最短距离为_____nm,与 K 紧邻的 O 个数为_____。
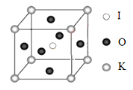
(4)在 KIO3 晶胞结构的另一种表示中,I 处于各顶角位置,则 K 处于_____________位置,O 处于_____位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
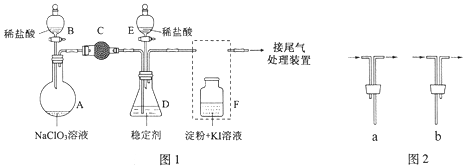
(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。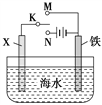
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:

①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O |
|
|
键能/(kJ·mol-1) | a | b | C | x |
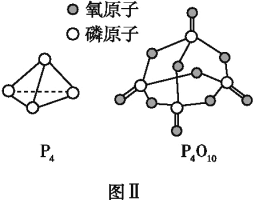
已知P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:

(1)元素C的最高价氧化物的电子式为____;元素G的离子结构示意图为____。
(2)元素L位于周期表的第_________族,1mol/L LM2溶液500mL与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为___________。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com