
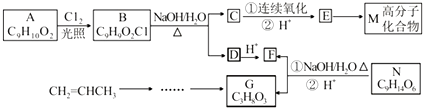
 .
. .
. .
.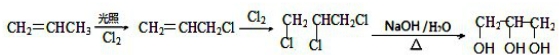 .
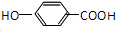
.分析 N碱性条件下水解、酸化生成的G、F物质的量之比为n(G):n(F)=1:3,则N中含有酯基,F分子中含有2个C原子,1 mol G与足量的金属钠反应产生H2 为$\frac{33.6L}{22.4L/mol}$=1.5mol,结合G的分子式可知G中含有3个羟基,则G为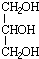 ,F为CH3COOH,N为
,F为CH3COOH,N为 .
.
化合物E与氯化铁溶液发生显色反应,说明E中含有苯环与酚羟基,由转化关系可知A中含有苯环与酚羟基,A与氯气在光照条件下发生侧链上取代反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C与D,D酸化得到F(乙酸),则D为CH3COONa,则C中含有7个C原子,C连续发生氧化反应,酸化得到E,说明C中含有-CH2OH结构,E中含有羧基,且E环上的一元取代物只有两种结构,则E为 ,
,
C为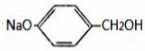 ,B为
,B为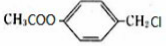 ,A为
,A为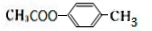 .CH2═CHCH3在光照条件下与氯气发生取代反应生成CH2═CHCH2Cl,然后与氯气发生加成反应生成ClCH2CHClCH2Cl,最后在氢氧化钠水溶液、加热条件下发生水解反应得到
.CH2═CHCH3在光照条件下与氯气发生取代反应生成CH2═CHCH2Cl,然后与氯气发生加成反应生成ClCH2CHClCH2Cl,最后在氢氧化钠水溶液、加热条件下发生水解反应得到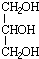 .
.
解答 解:N碱性条件下水解、酸化生成的G、F物质的量之比为n(G):n(F)=1:3,则N中含有酯基,F分子中含有2个C原子,1 mol G与足量的金属钠反应产生H2 为$\frac{33.6L}{22.4L/mol}$=1.5mol,结合G的分子式可知G中含有3个羟基,则G为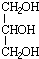 ,F为CH3COOH,N为
,F为CH3COOH,N为 .
.
化合物E与氯化铁溶液发生显色反应,说明E中含有苯环与酚羟基,由转化关系可知A中含有苯环与酚羟基,A与氯气在光照条件下发生侧链上取代反应生成B,B在氢氧化钠水溶液、加热条件下发生水解反应生成C与D,D酸化得到F(乙酸),则D为CH3COONa,则C中含有7个C原子,C连续发生氧化反应,酸化得到E,说明C中含有-CH2OH结构,E中含有羧基,且E环上的一元取代物只有两种结构,则E为 ,
,
C为 ,B为
,B为 ,A为
,A为 .
.
(1)E的结构简式: ,故答案为:
,故答案为: ;
;
(2)A.B为 ,可以发生水解反应,属于取代反应,F为CH3COOH,可以发生酯化反应,属于取代反应,故A正确;
,可以发生水解反应,属于取代反应,F为CH3COOH,可以发生酯化反应,属于取代反应,故A正确;
B.A为 ,甲基会被酸性高锰酸钾溶液氧化,G为
,甲基会被酸性高锰酸钾溶液氧化,G为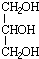 ,醇羟基可发生氧化反应,故B正确;
,醇羟基可发生氧化反应,故B正确;
C.F为CH3COOH,G为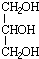 ,二者2:1反应生成C7H12O5,1:1反应生成C5H10O4,故C正确;
,二者2:1反应生成C7H12O5,1:1反应生成C5H10O4,故C正确;
D.从化合物A到M的转化过程中,没有涉及消去反应,故D错误,
故选:D;
(3)B转化为C和D的化学方程式: ,
,
故答案为: ;
;
(4)符合下列条件的化合物A( )的所有同分异构体的结构简式:
)的所有同分异构体的结构简式:
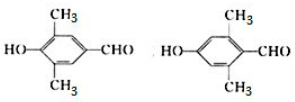
①含有苯环,且苯环上的一元取代物只有一种,②能与新制氢氧化铜悬浊液反应生成砖红色沉淀,且能与氯化铁溶液发生显色反应,含有酚羟基与醛基,符合条件的同分异构体有: ,
,
故答案为: ;
;
(5)CH2═CHCH3在光照条件下与氯气发生取代反应生成CH2═CHCH2Cl,然后与氯气发生加成反应生成ClCH2CHClCH2Cl,最后在氢氧化钠水溶液、加热条件下发生水解反应得到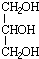 ,合成路线流程图为:
,合成路线流程图为: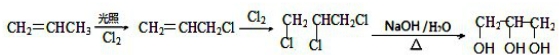 ,
,
故答案为: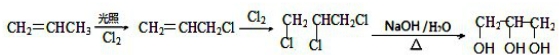 .
.
点评 本题考查有机物的推断与合成,根据有机物的分子式与性质进行分析解答,熟练掌握官能团的性质与转化,侧重考查学生分析推理能力,知识迁移运用能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用Na2S去除废水中的Hg2+,Hg2++S2-═HgS↓ | |
| B. | 向Fe(NO3)2溶液中滴人稀硫酸.溶液由浅绿色变为黄色3Fe2++4H++NO3-=3Fe2++NO↑+2H2O | |
| C. | 用醋酸、淀粉碘化钾试纸检测加碘食盐中是否有KIO3,IO3-+6I-+6H+=3I2+3H2O | |
| D. | 消毒液的主要成分为NaClO溶液,与洁厨灵混用.产生有毐Cl2,2H+++Cl-+ClO-=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水不可以长期排向水库 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com