
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
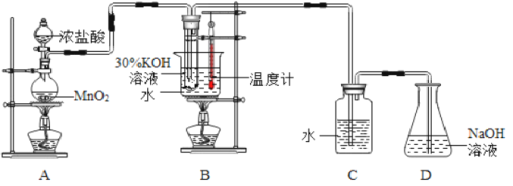
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。过滤操作过程中需要的玻璃仪器有__________。
(2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。D装置的作用是___________________。
(3)在实验过程中,若要检验C装置的瓶塞处是否密封好,请简述化学检验方案_______。
实验二 氯酸钾与碘化钾反应的研究
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.2molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是___________________________。
②设计1号试管实验的作用是__________________________。
③若2号试管实验现象为"黄色溶液",取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________________。
p>实验三 测定饱和氯水中氯元素的总量(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):____。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl﹣。
【答案】玻璃棒、漏斗、烧杯 能 吸收未反应完的氯气,防止污染空气 可用湿润的淀粉碘化钾试纸进行检测,若密封性不好,则试纸变为蓝色;若密封性好,则试纸不变色 研究反应体系中硫酸浓度对反应产物的影响 硫酸浓度为0的对照实验 ClO3- + 6I- +6H+ = Cl- + 3I2 + 3H2O 量取一定量的氯水试样,加入足量的H2O2溶液,充分反应后,再加入足量的硝酸银溶液,过滤洗涤干燥后,称量沉淀质量
【解析】
(1)过滤使用的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)氯气与热的KOH溶液反应产生氯酸钾、氯化钾和水,而制取的氯气中含有HCl杂质能与KOH反应,影响KClO3的产量,先使用装置C就可以除去Cl2中的HCl杂质,因此能够提高氯酸钾的产率;装置D中盛有NaOH溶液,用以除去未反应的氯气,防止污染空气;
(3)若装置C气密性不好,氯气会从中逸出,可以用湿润的淀粉碘化钾试纸进行检测,试纸变为蓝色;若装置气密性良好,则试纸不会变色;
(4) ①通过表格数据可知:反应其它条件相同,不同的是硫酸的浓度,故系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响;
②设计1号试管中硫酸溶液体积为0,即没有硫酸,该实验的作用是对照实验;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色,说明有I2生成;假设氧化产物唯一,还原产物为KCl,则根据氧化还原反应中电子守恒、电荷守恒、原子守恒的规律,可得该反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O;
(5)根据次氯酸会破坏酸碱指示剂,可知不能使用酸碱指示剂判断溶液的酸碱性;由次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-,可以向一定量的氯水中加入足量的H2O2溶液,充分反应后,再加入足量的硝酸银溶液,将产生的沉淀进行过滤、洗涤、干燥后,称量沉淀质量,可以确定反应产生了Cl-。


科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.6g纯净金属钠在干燥的空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是( )
A.只有Na2OB.只有Na2O2C.Na2O和Na2O2D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ②③ B. ①③④ C. ①④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。

请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有______。
(2)产生气体A的离子方程式为____________。
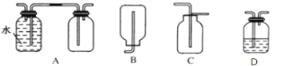
(3)在实验室中收集气体A,可选择如图装置中的______。
(4)写出④反应中生成溶液H的离子方程式____________。
(5)对不能确定是否存在的离子,请简述检测实验方案__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是
A.都有H2O生成 B.都有H2生成
C.都有AlO2-生成 D.都有Al3+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.100 0 mol·L-1 NaOH溶液滴定c mol·L-1某弱酸HA溶液,其滴定曲线如图所示。下列说法正确的是
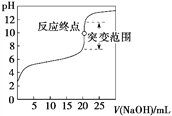
A. 可用甲基橙作滴定指示剂(已知甲基橙的变色范围为3.1~4.4,pH<3.1时溶液为红色,pH>4.4时溶液为黄色)
B. 指示剂指示的滴定终点就是反应终点
C. 突变范围的大小与酸的强弱及酸的浓度有关
D. 滴定时氢氧化钠溶液盛放在带活塞的滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A. 浓硫酸与Na2SO3固体发生了氧化还原反应
B. a、b均表明SO2具有漂白性
C. c中只可能发生反应:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3) + c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com