
| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙酸乙酯和油脂互为同系物 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
分析 A.石油的分馏为物理变化;
B.结构相似组成相差CH2的有机物为同系物,油脂为混合物;
C.有机物则原子或原子团被其他原子或原子团代替是的反应为取代反应,烷烃、苯及其同系物、醇、羧酸和酯类都能发生取代反应;
D.蔗糖、油脂不是高分子化合物.
解答 解:A.石油的分馏根据物质的沸点进行分离,为物理变化,故A错误;
B.乙酸乙酯喊一个酯键,油脂是高级脂肪酸甘油酯,核内三个酯键,结构不相似,不能互为同系物,故B错误;
C.在.一定条件下,烷烃、苯及其同系物、醇、羧酸和酯类都能发生取代反应,注意酯类的水解反应属于取代反应,故C正确;
D.高分子化合物的相对分子质量一般在10000以上,蔗糖、油脂不是高分子化合物,故D错误.
故选C.
点评 本题综合考查有机物的结构和性质,为历年高考常见题型和高频考点,题目多角度考查物质的组成、结构、官能团的性质等知识,有利于学生良好科学素养的培养,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 甲烷和乙烷 | ||
| C. | 石墨和C60 | D. | 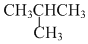 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的氧化物属于碱性氧化物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | W的氧化物对应的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CH CH2 CH2CH3 | B. | (CH3 CH2)2CHCH3 | ||
| C. | (CH3)3CCH2CH3 | D. | (CH3)2CHCH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
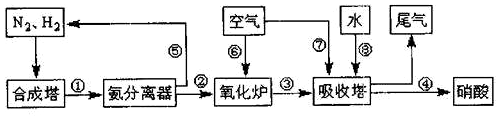

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com