
分析 (1)硫化亚铁与盐酸反应生成硫化氢和氯化亚铁,依据n=$\frac{m}{M}$=CV计算反应物的物质的量,结合方程式判断反应物过量与不足;
(2)根据气体在溶液中的溶解性可以推算能够收集的气体的体积;
(3)依据方程式FeS+2HCl═FeCl2 +H2S计算生成氯化亚铁物质的量,依据c=$\frac{n}{V}$计算二价铁离子浓度.
解答 解:(1)n(FeS)=$\frac{m(FeS)}{M(FeS)}$=$\frac{8.8g}{88g/mol}$=0.1mol,n(HCl)=0.2L×2.0mol•L-1=0.4mol,200mL2.0mol/L的盐酸中含义氯化氢物质的量为:0.2L×2mol/L=0.4mol,依据方程式:
FeS+2HCl═FeCl2 +H2S
1mol 2mol 1mol
0.1mol 0.4mol n(H2S)
依据方程式可知:0.1mol硫化亚铁完全反应需要氯化氢物质的量为0.2mol,所以盐酸过量,
答:反应的方程式:FeS+2HCl═FeCl2 +H2S;盐酸过量;
(2)依据方程式:FeS+2HCl═FeCl2 +H2S可知,0.1mol硫化亚铁完全反应生成0.1mol硫化氢气体,在溶液中溶解的物质的量为:
0.10mol•L-1×0.2L=0.02mol,所以收集到的H2S气体的物质的量为0.1mol-0.02mol=0.08mol,
其体积为:V(H2S)=n(H2S)×Vm=0.08mol×22.4L/mol=1.8L,
收集到的H2S气体的体积(标准状况)为1.8L;
答:可收集到的H2S气体在标况下的体积为1.8L;
(3)参加反应的FeS的物质的量0.1mol,
FeS+2HCl═FeCl2+H2S↑
1 1
0.1mol n(FeCl2)
n(FeCl2)=0.1mol,C(FeCl2)=$\frac{n{\;}_{(FeC{l}_{2})}}{V}$=$\frac{0.1mol}{0.2L}$=0.5mol•L-1,
答:溶液中FeCl2的物质的量浓度为0.5mol•L-1.
点评 本题考查了物质的量浓度、方程式的有关计算,明确以物质的量为核心计算公式是解题关键,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
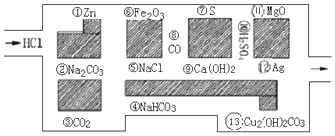

 (物质序号)
(物质序号)查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③⑤ | C. | ①②④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 | |
| B. | 对于上述平衡,加人适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 | |
| C. | 第②步中,还原 0.1molCr2O72-需要45.6gFeSO4 | |
| D. | 第③步沉淀剂a可以使用NaOH等碱性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
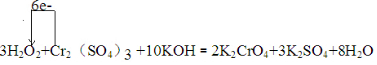 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫元素被氧化,所有铁元素均被还原 | |
| B. | 当转移1mol电子时,46 g CuFeS2参加反应 | |
| C. | 氧化产物是S,还原产物是Cu2+和Fe2+ | |
| D. | 还原剂是S2-,氧化剂是Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
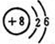
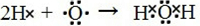
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com