
| A. | CO2 | B. | PCl5 | C. | NH3 | D. | HClO |
分析 对ABn型分子,A的族序数+成键数=8,则满足所有原子都满足最外层8电子结构,含有H元素的化合物中H元素一定不满足8电子结构.
解答 解:A.CO2中,C原子的族序数+成键数=4+4=8,所以满足所有原子最外层为8电子结构,故A正确;
B.PCl5中,P原子的族序数+成键数=5+5=10,所以不满足所有原子最外层为8电子结构,故B错误;
C.NH3中H原子最外层满足2电子结构,故C错误;
D.HClO分子中H原子最外层满足2电子结构,故D错误;
故选A.
点评 本题考查原子核外电子排布和化学键,注意原子的最外层电子数及判断ABn型分子的一般规律来解答,题目难度中等,注意次氯酸的中心原子是O原子而不是Cl原子,为易错点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于d | |
| B. | 若从正反应开始平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 若平衡体系中气体M mol,再充入bmolB,达到平衡气体量为(M+b)mol,则a+b=c+d | |
| D. | 若a+b=d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药 | |
| B. | 对燃煤进行脱硫处理 | |
| C. | 对塑料等垃圾进行深埋或倾倒入海处理 | |
| D. | 推广使用节能环保材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3-+OH+$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+H2O | |
| C. | 稀硝酸除银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 钢笔使用不同牌子的墨水堵塞 | |
| C. | 一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 | |
| D. | 向石灰水中通入二氧化碳气体产生白色浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
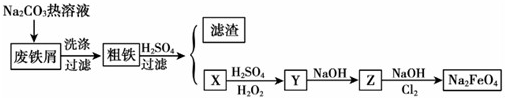
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com