
有五种氧化物:三氧化二铝、氧化镁、氧化铁、氧化铜、氧化钠。
请依次阅读①~④的描述。
①a能溶于水中,形成强碱溶液。
②b、c均为白色不溶于水的固体,b能溶于a形成的水溶液中,c不能。
③d是黑色固体,溶于稀盐酸后,溶液呈蓝色。
④e是红棕色粉末。
回答下列问题:
⑴确定a~e分别代表上述哪一种氧化物,把答案填在表内(填化学式)。
代号 | a | b | c | d | e |
氧化物 |
|
|
|
|
|
⑵写出②中有关反应的离子方程式: 。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:阅读理解
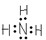
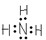
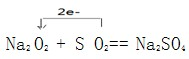
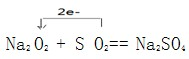
查看答案和解析>>
科目:高中化学 来源: 题型:
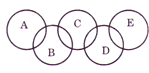 如图,A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质.在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应.且B的相对分子质量小于D.
如图,A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质.在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应.且B的相对分子质量小于D.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
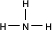
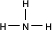
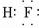


| A | C | |
| B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com