
| ||
| ||


科目:高中化学 来源: 题型:
| A、含金属元素的离子也可能是阳离子 |
| B、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| C、金属氧化物一定是碱性氧化物 |
| D、SiO2是酸性氧化物,所以不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:3 |
| C、6:3:2 |
| D、1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
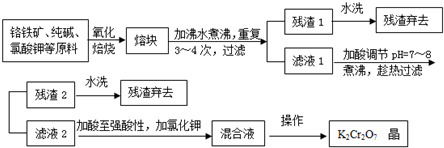
| ||
| ||
| 温 度 | 10℃ | 20℃ | 50℃ | 80℃ | 100℃ |
| K2Cr2O7溶解度(g) | 8.5 | 13.1 | 37.0 | 73.0 | 102.0 |
| NaCl溶解度(g) | 35.8 | 36.0 | 37.0 | 38.4 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
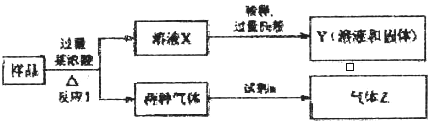
查看答案和解析>>
科目:高中化学 来源: 题型:
| 叙述 | 解释 | |
| A | NaCl的熔沸点比KCl低 | NaCl的晶格能小于KCl |
| B | CH4的一氯代物只有一种结构 | CH4是正四面体结构 |
| C | 乙烯容易发生加成反应 | π键键能较小,容易断裂 |
| D | 葡萄糖可以发生银镜反应 | 分子中含有-CHO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com