
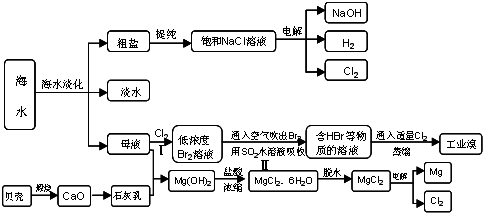
海水占地球总储水量的97%以上。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上使用的“海水淡化”主要技术有_______________________________________。
(2)工业上利用电解饱和食盐水可制得重要化工产品,用离子交换膜电解槽电解饱和食盐水,反应的离子方程式是__________________________________________________________,
阳离子交换膜的作用是________________________________________________________。
若不使用离子交换膜法电解食盐水,可得到一种消毒液,其反应的化学方程式是
________________________________________________________________________。
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,写出此过程中SO2被吸收以及又生成可被回收的气体的两个反应的化学方程式________________________________________________________________________。
(1)蒸馏法、电渗析法、反渗透法、冷冻法、离子交换法等
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑ 只允许阳极室的Na+和H+透过离子交换膜进入阴极室,阻止Cl2从阳极室迁移到阴极室 Cl2+2NaOH===NaCl+NaClO+H2O
2OH-+H2↑+Cl2↑ 只允许阳极室的Na+和H+透过离子交换膜进入阴极室,阻止Cl2从阳极室迁移到阴极室 Cl2+2NaOH===NaCl+NaClO+H2O
(3)NaOH+SO2===NaHSO3(或2NaOH+SO2===Na2SO3+H2O),NaHSO3+HCl===NaCl+H2O+SO2↑(或Na2SO3+2HCl===2NaCl+H2O+SO2↑)
【解析】
试题分析:(1)目前国际上使用的“海水淡化”主要技术有蒸馏法、电渗析法、反渗透法、冷冻法、离子交换法等。
(2)电解饱和食盐水的离子方程式是2Cl-+2H2O 2OH-+H2↑+Cl2↑。由于阳离子交换膜只允许阳极室的Na+和H+透过离子交换膜进入阴极室,从而阻止Cl2从阳极室迁移到阴极室。如果没有使用阳离子交换膜,则产生的氯气就能和氢氧化钠反应生成氯化钠和次氯酸钠,反应的化学方程式是Cl2+2NaOH===NaCl+NaClO+H2O。
2OH-+H2↑+Cl2↑。由于阳离子交换膜只允许阳极室的Na+和H+透过离子交换膜进入阴极室,从而阻止Cl2从阳极室迁移到阴极室。如果没有使用阳离子交换膜,则产生的氯气就能和氢氧化钠反应生成氯化钠和次氯酸钠,反应的化学方程式是Cl2+2NaOH===NaCl+NaClO+H2O。
(3)SO2是酸性氧化物,能和氢氧化钠反应生成亚硫酸钠或亚硫酸氢钠。而亚硫酸钠或亚硫酸氢钠又能和酸反应重新释放出SO2,反应的化学方程式是NaOH+SO2===NaHSO3(或2NaOH+SO2===Na2SO3+H2O),NaHSO3+HCl===NaCl+H2O+SO2↑(或Na2SO3+2HCl===2NaCl+H2O+SO2↑)。
考点:考查海水淡化技术、电解饱和食盐水的判断、应用以及SO2的吸收等
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,难易适中。本题是海水利用的综合题,涉及海水淡化、电解饱和食盐水及环境保护的知识,有利于培养学生学生的逻辑思维能力,提高学生分析问题、解决问题的能力。


科目:高中化学 来源: 题型:


| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com